Anilin
| Anilin | |||
|---|---|---|---|
| |||
| Tổng quan | |||
| Tên khác | Phenylamin Aminobenzen Benzenamin | ||
| Số CAS | [62-53-3] | ||
| Công thức hóa học | C6H7N | ||
| SMILES | NC1=CC=CC=C1 | ||
| Khối lượng phân tử | 93,13 g/mol | ||
| Bề ngoài | chất lỏng không màu | ||
| Thuộc tính | |||
| Tỷ trọng và pha | 1,0217 g/ml, lỏng | ||
| Độ hoà tan trong ethanol, aceton | có thể hoà tan | ||
| Nhiệt độ nóng chảy | - 6,3 °C | ||
| Nhiệt độ sôi | 184,13 °C | ||
| Độ hoà tan trong nước | 3,6 g/100 ml ở 20 °C | ||
| Hằng số axit (pKa) | 4.87 | ||
| Hằng số base (pKb) | 9.4202 | ||
| Độ nhớt | 3,71 cP ở 25 °C | ||
| Dữ liệu nhiệt động | |||
| Entanpy cháy ΔcH |
-3394 kJ/mol | ||
| Nguy hiểm | |||
| MSDS | MSDS ngoài | ||
| Phân loại của EU | Độc (T) Gây ung thư Gây đột biến gen Nguy hiểm với môi trường | ||
| NFPA 704 |
| ||
| Nguy hiểm | R23/24/25, R40, R41, R43, R48/23/24/25, R68, R50 | ||
| An toàn | S1/2, S26, S27, S36/37/39, S45, S46, S61, S63 | ||
| Dữ liệu bổ sung | |||
| Cấu trúc và tính chất |
n, εr, v.v.. | ||
| Tính chất nhiệt động |
Pha Rắn, lỏng, khí | ||
| Anilin (dữ liệu)#Phổ | UV, IR, NMR, MS | ||
| Hóa chất liên quan | |||
| Amin thơm liên quan | 1-Naphthylamin 2-Naphthylamin | ||
| Hợp chất liên quan | Phenylhydrazin Nitrosobenzen Nitrobenzen | ||
| Ngoại trừ có thông báo khác, các dữ liệu được lấy ở 25 °C, 100 kPa Thông tin về sự phủ nhận và tham chiếu | |||
Anilin (bắt nguồn từ từ tiếng Pháp aniline /anilin/),[1] còn được viết là a-ni-lin,[1] cũng còn được gọi là phenyl amin hay amino benzen là hợp chất hữu cơ thuộc dãy đồng đẳng amin với công thức phân tử C6H7N. Nó là một trong những amin thơm đơn giản nhất và quan trọng nhất. Ứng dụng chủ yếu của nó là để sản xuất PU (poly ure). Giống như các amin thơm khác, nó có mùi khó chịu của cá ươn. Anilin ít tan trong nước (trừ khi đun sôi), khi dây vào da sẽ gây bỏng rát. Cồn, xăng, dầu ăn dễ dàng hòa tan anilin do đó để xử lý các anilin bị đổ, người ta dùng cồn hoặc xăng. Anilin cũng là một chất độc có mùi xốc. Nó cháy dễ dàng tạo ra khói.
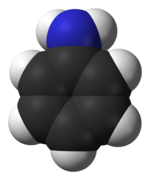
Cấu trúc
[sửa | sửa mã nguồn]Bao gồm một nhóm phenyl liên kết với một nhóm amin. Anilin là một phân tử hơi hình tháp, với sự lai tạp của nitơ ở đâu đó giữa sp 3 và sp 2 . Kết quả là, cặp nitơ đơn độc nằm trong một orbital lai hóa sp x với đặc tính p cao. Nhóm amino trong anilin phẳng hơn (ví dụ, nó có dạng "hình tháp nông hơn") so với nhóm amino trong amin béo, do sự liên hợp của cặp đơn với nhóm thế aryl . Hình học quan sát được phản ánh một thỏa hiệp giữa hai yếu tố cạnh tranh: 1) ổn định của cặp e N trong một quỹ đạo với nhân vật quan trọng của thiên pyramidalization (quỹ đạo với s nhân vật thấp về năng lượng), trong khi 2) delocalization của N cặp đơn lẻ vào vòng aryl tạo ra sự thuần nhất (một cặp đơn lẻ trong một quỹ đạo p thuần túy tạo ra sự xen phủ tốt nhất với các obitan của hệ thống vòng π của benzen). [7]
Phù hợp với các yếu tố này, các anilin được thay thế bằng các nhóm cho điện tử có hình chóp hơn, trong khi các anilin có nhóm rút điện tử sẽ phẳng hơn. Ở anilin mẹ, cặp đơn lẻ có ký tự xấp xỉ 12% s, tương ứng với phép lai sp 7.3 . [7] (Để so sánh, các ankylamin thường có các cặp đơn lẻ trong các orbital gần với sp 3. )
Góc hình chóp giữa liên kết C – N và phân giác của góc H – N – H là 142,5 °. [8] (Để so sánh, trong metylamin hình tháp mạnh hơn, giá trị này là ~ 125 °, trong khi nitơ phẳng như của formamit có góc 180 °.) Khoảng cách C – N cũng ngắn hơn tương ứng. Trong anilin, độ dài liên kết C – N là 1,41 Å, [9] so với 1,47 Å đối với xyclohexylamin, [10] cho thấy liên kết π một phần giữa N và C. [11]
Điều chế
[sửa | sửa mã nguồn]Đầu tiên, benzen được nitrat hoá bởi hỗn hợp đậm đặc axit nitric và axit sunfuric ở 50-60 °C, tạo ra nitrobenzen:
Đây là một trong những quy trình sản xuất nguy hiểm nhất do phản ứng toả nhiệt mạnh, có thể gây nổ.
Tiếp theo, nitrobenzen được chuyển hoá thành anilin:
Các chất xúc tác chính được sử dụng là các kim loại nhóm 10 như nickel, palladium và platin.
Ngoài ra, anilin có thể được điều chế theo cách khác từ amoniac và phenol có nguồn gốc từ cumene .
Tính chất
[sửa | sửa mã nguồn]Anilin oxi hoá chậm trong không khí, tạo những vết màu nâu đen.
Tính base
[sửa | sửa mã nguồn]Anilin là một base yếu. Những amin thơm như anilin có tính base yếu hơn amoniac. Anilin rất ít tan trong nước nhưng nước đun sôi có thể hòa tan được anilin. Dung dịch của nó không làm đổi màu quỳ tím.
Tính chất của vòng benzen
[sửa | sửa mã nguồn]Do phân tử có nhóm -NH2 nên mật độ electron của vòng benzen cao hơn so với benzen. Do đó, khi thực hiện phản ứng thế thì 2 vị trí ortho và para(so với nhóm -NH2) sẽ được ưu tiên thế và phản ứng diễn ra khá dễ dàng.
Tính chất của nhóm amin
[sửa | sửa mã nguồn]Anilin phản ứng với acid nitrogen ở nhiệt độ thấp (0-5 độ C) sinh ra các hợp chất diazoni
C6H5NH2 + HONO -> C6H5N2+Cl- + 2H2O
Các hợp chất diazoni lại là tiền chất sản xuất thuốc nhuộm azo. Do đó, một lượng lớn anilin được sản xuất để là nguyên liệu sản xuất các loại thuốc nhuộm khác.
Anilin cũng có khả năng phản ứng với các alcohol. Đây được gọi là phản ứng Friedel- Craft.
C6H5NH2 + 2CH3OH → C6H5N(CH3)2 + 2H2O
C6H5NH2 + CH3OH → C6H5NHCH3+ H2O
Anilin cũng có thể phản ứng trực tiếp với các dẫn xuất halogen, cũng thu được các hợp chất amin bậc hai hoặc bậc ba. Sau đó, NaOH/KOH sẽ được sử dụng để tách acid halogenic ra khỏi hỗn hợp.
Ứng dụng
[sửa | sửa mã nguồn]Phần lớn anilin được dùng để sản xuất metylendianilin. Ngoài ra, chúng còn được dùng để sản xuất thuốc nhuộm, chế biến cao su, sản xuất polime, thuốc chữa bệnh....
Một lượng lớn anilin được dùng để sản xuất 4,4′-Methylenedianiline ( MDA ) mà chính nó lại được dùng để sản xuất Auramine O.
Tham khảo
[sửa | sửa mã nguồn]Liên kết ngoài
[sửa | sửa mã nguồn]- Avogadro savety sheet Lưu trữ 2006-10-04 tại Wayback Machine
- Acros savety sheet
- International Chemical Safety Card 0011
- National Pollutant Inventory - Aniline Lưu trữ 2006-09-10 tại Wayback Machine
- NIOSH Pocket Guide to Chemical Hazards
- IARC Monograph "Aniline" Lưu trữ 2005-10-12 tại Wayback Machine
- Computational Chemistry Wiki entry Lưu trữ 2007-09-27 tại Wayback Machine
- Aniline electropolymerisation
