Tartarato de sódio e potássio
Este artigo não cita fontes confiáveis. (Maio de 2022) |
| Tartarato de sódio e potássio Alerta sobre risco à saúde | |
|---|---|
| |
| Nome IUPAC | Tartarato de sódio e potássio |
| Outros nomes | E337 |
| Identificadores | |
| Número CAS | |
| Número EINECS | |
| Propriedades | |
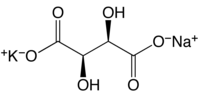
| Fórmula molecular | KNaC4H4O6·4H2O |
| Massa molar | 282.1 g/mol |
| Ponto de fusão |
75 °C |
| Ponto de ebulição |
220 °C |
| Compostos relacionados | |
| Outros catiões/cátions | Tartarato de sódio Tartarato de potássio Bitartarato de potássio |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Tartarato de sódio e potássio é um sal duplo primariamente preparado (em torno de 1675) por um boticário, Pierre Seignette, de La Rochelle, França. Como resultado o sal ficou conhecido como sal de Seignette ou sal de La Rochelle.
É um sal incolor a branco azulado cristalizando no sistema ortorrômbico. Sua fórmula molecular é KNaC4H4O6·4H2O. É levemente solúvel em álcool mas mais completamente solúvel em água. Tem densidade de aproximadamente 1,79, um ponto de fusão de aproximadamente 75 °C, e tem um gosto salino e refrescante. Como aditivo alimentar, seu número E é E337.
Usos
[editar | editar código-fonte]Tem sido usado medicinalmente como um purgativo, mas também, por suas propriedades piezoelétricas, o sal tem encontrado uso em fonógrafos, nos tocadores de discos de vinil e outros equipamentos com componentes nos quais seja necessária sensibilidade à pressão. Ele também tem sido usado no processo de prateamento de espelhos. É um ingrediente da solução de Fehling, convencionalmente usado na determinação de açúcares redutores e soluções.
Em síntese orgânica, é usado em trabalhos em meios aquosos para romper emulsões, particularmente naquelas em que um reagente hidreto baseado em alumínio tenha sido usado.
É também um ingrediente no Reagente de biureto, usado para medição de concentração de proteínas.
Preparação
[editar | editar código-fonte]Pela neutralização de cremor de tártaro (bitartarato de potássio) com carbonato de sódio (barrilha) ou bicarbonato de sódio. Dissolver cerca de 200g de cremor de tártaro em 250ml de água quente. Adicionar o carbonato de sódio (ou bicarbonato) aos poucos (uma colherada pequena de cada vez) até que não ocorram mais borbulhas (CO2). A solução resultante é coberta com um pano(para evitar poeira ou insetos) e deixada para evaporar até que se formem cristais. Um caminho opcional é ferver a solução neutralizada até que esta atinja a viscosidade de um melado e depois deixar a solução em repouso até que se formem os cristais. Em ambos os casos a formação de cristais pode levar vários dias e o resultado pode ser uma massa pastosa de cristais finos. A formação de cristais grandes é mais provável se for feita a evaporação lenta da solução neutralizada.
Observações: Existem substitutos culinários para o cremor de tártaro que não são compostos de bitartarato de potássio. Estes, evidentemente, não servem para a produção de sal de Rochelle.
Referências
[editar | editar código-fonte]