레티날
| |

| |
| 이름 | |
|---|---|
| IUPAC 이름
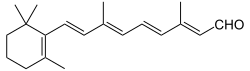
(2E,4E,6E,8E)-3,7-Dimethyl-9-(2,6,6-trimethylcyclohexen-1-yl)nona-2,4,6,8-tetraenal
| |
별칭
| |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.003.760 |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| C20H28O | |
| 몰 질량 | 284.443 g·mol−1 |
| 겉보기 | Orange crystals from petroleum ether[1] |
| 녹는점 | 61 to 64 °C (142 to 147 °F; 334 to 337 K)[1] |
| Nearly insoluble | |
| fat에서의 용해도 | Soluble |
| 관련 화합물 | |
관련 화합물
|
retinol; retinoic acid; beta-carotene; dehydroretinal; 3-hydroxyretinal; 4-hydroxyretinal |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |

레티날(영어: retinal)은 레티넨의 한 종류로, 레티날데하이드(영어: retinaldehyde) 혹은 비타민 A 알데하이드(영어: vitamin A aldehyde)라고도 한다.[2][3] 종마다 다양한 형태의 비타민 A가 존재하는데, 레티날 역시 비타민 A의 한 형태이다. 레티날은 폴리엔(polyene) 발색단으로, 옵신이라는 단백질에 결합하고 동물의 시각과 관련이 있다. 레티날은 또한 제1형 로돕신 단백질에 결합하여 특정한 미생물이 빛을 대사 에너지로 전환하도록 한다.
척추동물이 레티날을 얻는 방법으로는 고기를 섭취하거나, 카로틴(α-카로틴, β-카로틴)으로부터 생산하거나, 엽황소의 일종인 β-크립토잔틴이라는 또 다른 카로티노이드로부터 합성한다. 원료인 카로틴이나 엽황소는 식물이나 기타 광합성 생물에서 얻어야 한다. 다른 카로티노이드는 동물이 레티날로 전환할 수 없고, 몇몇 육식동물은 카로티노이드를 아예 레티날로 전환하지 못한다. 비타민 A의 주요 형태 중 레티놀과 부분적 활성형인 레티노산은 레티날에서 합성될 수 있다.
곤충이나 오징어 등 무척추동물은 하이드록시형 레티날을 시각계에서 사용한다. 이들은 다른 엽황소를 전환하여 레티날을 얻는다.
비타민 A 대사
[편집]생물은 카로티노이드를 절단하는 비가역적 산화반응을 통하여 레티날을 생산한다.[4] 이 반응은 β-카로틴 15,15'-모노옥시저네이스[5] 또는 β-카로틴 15,15'-다이옥시저네이스가[6] 촉매작용한다.
- β-카로틴 + O2 → 2 retinal
카로티노이드가 레티날의 전구체인 것처럼 레티날은 다양한 형태의 비타민 A의 전구체이다. 레티날은 레티놀로 혹은 반대로 전환될 수 있다. 레티놀은 저장 및 수송형 비타민 A이며, 비타민 A 알코올이라고도 하고, 간단히 비타민 A라고 하기도 한다. 이 반응은 레티놀 탈수소효소[7]와 알코올 탈수소효소[8]가 촉매작용한다.
레티날은 산화되어 레티노산으로 산화될 수도 있다.
- 레티날 + NAD+ + H2O → 레티노산 + NADH + H+ (레티날 탈수소효소[9]가 촉매)
- 레티날 + O2 + H2O → 레티노산 + H2O2 (레티날 산화효소[10]가 촉매)
레티날 탈수소효소는 레티날데하이드 탈수소효소(RALDH)라고도 한다.[8] 레티노산은 비타민 A 산이라고도 불리며, 척추동물에서 신호 분자와 호르몬 역할을 한다.
시각
[편집]
시각은 레티날이 빛에 의하여 이성질체로 변하면서(photoisomerization) 시작된다. 11-시스-레티날 발색단이 광자를 흡수하면 전(全)-트랜스형 이성질체로 변한다. 발색단의 흡수 스펙트럼은 발색단이 결합하고 있는 옵신과 상호작용에 따라 결정된다. 즉, 옵신의 종류가 다르면 흡수 스펙트럼이 달라진다.
옵신
[편집]옵신은 단백질이고 레티날이 결합하고 있는 시각 색소이다. 눈의 망막에 있는 광수용기 세포에 있다. 옵신은 막관통 알파 나선 일곱 개가 고리 여섯 개로 연결된 형태이다. 막대세포에 있는 옵신 분자는 세포 내에 있는 원반의 막에 묻혀있다. 옵신 분자의 N-말단 머리는 원반 안에 뻗어 있고, C-말단 꼬리는 세포질에 뻗어 있다. 원뿔세포에서 원반은 세포의 원형질막으로 구분되기 때문에, N-말단 머리는 세포 바깥으로 뻗어 있는 꼴이다. 레티날은 C-말단에 가장 가까운 막통과 나선의 라이신 잔기에 쉬프 염기 연결을 통하여 공유적으로 결합한다. 쉬프 염기 연결을 통하여 레티날에서 산소 원자를, 라이신의 유리 아미노기에서 수소 원자 두 개를 제거하여 물을 생성한다. 레티날에서 산소 원자를 제거하고 형성된 2가 작용기를 레티닐리딘(retinylidene)이라고 하므로, 옵신은 레티닐리딘 단백질이라고 불렸다.
옵신은 G 단백질 연결 수용체(GPCR)에 속한다.[11] 소의 로돕신은 X선 결정학으로 구조가 밝혀진 최초의 GPCR이다.[12] 348개 아미노산 잔기로 이루어져 있고, 레티날 발색단은 Lys296에 결합한다.
포유동물은 옵신 발색단으로 거의 대부분 레티날을 사용하지만, 기타 동물은 레티날과 밀접한 관련이 있는 네 종류의 발색단을 사용한다. 3,4-다이디하이드로레티날, (3R)-3-하이드록시레티날, (3S)-3-하이드록시레티날, (4R)-4-하이드록시레티날이 그것이다. 어류와 양서류는 디하이드로레티날이라고도 하는 3,4-다이디하이드로레티날을 사용한다. 흔히 파리라고 하는 쌍시류의 아목인 가락지감침파리아목(Cyclorrhapha)을 제외하고 곤충은 대부분 3-하이드록시레티날의 (R)-광학이성질체를 사용한다. 초파리를 포함하여 가락지감침파리아목에 속하는 무리는 (3S)-3-하이드록시레티날을 사용한다.[13][14] 반딧불오징어(Watasenia scintillans)는 (4R)-4-하이드록시레티날을 사용한다.
시각주기
[편집]
빛 정보를 전달하는 신호전달체계는 순환하는 효소 경로로 이루어져 있고, 11-시스-레티날을 재생성한다. 포유동물 막대세포의 시각주기는 아래와 같다.
- 전(全)-트랜스-레티닐 에스터 + H20 → 11-시스-레티놀 + 지방산 (효소는 RPE65 아이소머로가수분해효소)[15]
- 11-시스-레티놀 + NAD+ → 11-시스-레티날 + NADH + H+ (효소는 11-시스-레티놀 탈수소효소)
- 11-시스-레티날 + 아포로돕신 → 로돕신 + H2O (라이신에 쉬프 염기 연결이 형성된다. -CH=N+H-,
- 로돕신 + hν → 메타로돕신 II; 11-시스가 전-트랜스로 광이성질체화된다.
- 로돕신 + hν → 포토로돕신 → 바토로돕신 → 루미로돕신 → 메타로돕신 I → 메타로돕신 II,
- 메타로돕신 II + H2O → 아포로돕신 + 전-트랜스-레티날
- 전-트랜스-레티날 + NADPH + H+ → 전-트랜스-레티놀 + NADP+ (효소는 전-트랜스-레티놀 탈수소효소)
- 전-트랜스-레티놀 + 지방산 → 전-트랜스-레티닐 에스터 + H2O (효소는 레시틴 레티놀 아실전이효소(LRATs))[16]
3, 4, 5, 6단계는 막대세포의 바깥 분절에서 일어난다. 1, 2, 7단계는 망막 색소 상피세포에서 일어난다.

RPE65 아이소머로가수분해효소는 베타카로틴 모노옥시제네이스와 상동이다.[4] 초파리 Drosophila에 있는 ninaB 효소 상동체는 레티날을 형성하는 카로티노이드 옥시제네이스 활성과 전-트랜스형을 11-시스형으로 전환하는 이성질화효소 활성을 모두 가지고 있다.[17]
제1형 로돕신
[편집]전(全)-트랜스-레티날은 미생물에 있는 제1형 옵신을 구성하는 주요 성분이기도 하다. 제1형 옵신에는 박테리오로돕신, 채널로돕신, 할로로돕신 등이 있다. 이들 분자가 빛을 받으면 전-트랜스-레티날이 13-시스레티날로 변하고[18] 다시 어두운 상태에서는 전-트랜스-레티날로 되돌아온다.
역사
[편집]미국의 생화학자 조지 월드와 동료들은 1958년 시각주기를 대략적으로 밝혔고, 그 공로로 핼던 케퍼 하틀라인과 랑나르 그라니트와 함께 1967년 노벨 생리학·의학상을 수상하였다.[19]
같이 보기
[편집]각주
[편집]- ↑ 가 나 Merck Index, 13th Edition, 8249
- ↑ MORTON, R. A.; GOODWIN, T. W. (1944년 4월 1일). “Preparation of Retinene in Vitro”. 《Nature》 153 (3883): 405–406. doi:10.1038/153405a0.
- ↑ BALL, S; GOODWIN, TW; MORTON, RA (1946). “Retinene1-vitamin A aldehyde.”. 《The Biochemical Journal》 40 (5-6): lix. PMID 20341217.
- ↑ 가 나 von Lintig J, Vogt K (2000). “Filling the Gap in Vitamin A Research: Molecular Identification of An Enzyme Cleaving Beta-carotene to Retinal”. 《Journal of Biological Chemistry》 (ASBMB) 275 (16): 11915–11920. doi:10.1074/jbc.275.16.11915. PMID 10766819.
- ↑ Woggon, Wolf-D. (2002). “Oxidative cleavage of carotenoids catalyzed by enzyme models and beta-carotene 15,15´-monooxygenase”. 《Pure and Applied Chemistry》 (IUPAC) 74 (8): 1397–1408. doi:10.1351/pac200274081397.
- ↑ Kim YS, Kim NH, Yeom SJ, Kim SW, Oh DK (2009). “In Vitro Characterization of a Recombinant Blh Protein from an Uncultured Marine Bacterium as a β-Carotene 15,15′-Dioxygenase”. 《Journal of Biological Chemistry》 (ASBMB) 284 (23): 15781–93. doi:10.1074/jbc.M109.002618. PMC 2708875. PMID 19366683.
- ↑ Lidén M Eriksson U (2006). “Understanding Retinol Metabolism: Structure and Function of Retinol Dehydrogenases”. 《Journal of Biological Chemistry》 (ASBMB) 281 (19): 13001–13004. doi:10.1074/jbc.R500027200. PMID 16428379.
- ↑ 가 나 Duester, G (2008년 9월). “Retinoic Acid Synthesis and Signaling during Early Organogenesis”. 《Cell》 134 (6): 921–31. doi:10.1016/j.cell.2008.09.002. PMC 2632951. PMID 18805086.
- ↑ Lin M, Zhang M, Abraham M, Smith SM, Napoli JL. (2003). “Mouse Retinal Dehydrogenase 4 (RALDH4), Molecular Cloning, Cellular Expression, and Activity in 9-cis-Retinoic Acid Biosynthesis in Intact Cells”. 《Journal of Biological Chemistry》 (ASBMB) 278 (11): 9856–9861. doi:10.1074/jbc.M211417200. PMID 12519776.
- ↑ “KEGG ENZYME: 1.2.3.11 retinal oxidase”. 2009년 3월 10일에 확인함.
- ↑ Lamb, T D (1996). “Gain and kinetics of activation in the G-protein cascade of phototransduction”. 《Proceedings of the National Academy of Sciences》 93 (2): 566–570. Bibcode:1996PNAS...93..566L. doi:10.1073/pnas.93.2.566. PMC 40092. PMID 8570596.
- ↑ Palczewski K, Kumasaka T,; Behnke CA, Motoshima H, Fox BA, Le Trong I, Teller DC, Okada T, Stenkamp RE, Yamamoto M, Miyano M (2000). “Crystal Structure of Rhodopsin: A G Protein-Coupled Receptor”. 《Science》 (AAAS) 289 (5480): 739–745. doi:10.1126/science.289.5480.739. PMID 10926528. 이름 목록에서
|이름3=이(가) 있지만|성3=이(가) 없음 (도움말); 이름 목록에서|성3=이(가) 없음 (도움말) - ↑ Seki T, Isono K, Ito M, Katsuta Y (1994). “Flies in the Group Cyclorrhapha Use (3S)-3-Hydroxyretinal as a Unique Visual Pigment Chromophore”. 《European Journal of Biochemistry》 (Wiley) 226 (2): 691–696. doi:10.1111/j.1432-1033.1994.tb20097.x. PMID 8001586.
- ↑ Seki T, Isono K, Ozaki K, Tsukahara Y, Shibata-Katsuta Y, Ito M, Irie T, Katagiri M (1998). “The metabolic pathway of visual pigment chromophore formation in Drosophila melanogaster: All-trans (3S)-3-hydroxyretinal is formed from all-trans retinal via (3R)-3-hydroxyretinal in the dark”. 《European Journal of Biochemistry》 (Wiley) 257 (2): 522–527. doi:10.1046/j.1432-1327.1998.2570522.x. PMID 9826202.
- ↑ Moiseyev G, Chen Y, Takahashi Y, Wu BX, Ma J (2005). “RPE65 is the isomerohydrolase in the retinoid visual cycle”. 《Proceedings of the National Academy of Sciences》 102 (35): 12413–12418. Bibcode:2005PNAS..10212413M. doi:10.1073/pnas.0503460102. PMC 1194921. PMID 16116091.
- ↑ Jin M, Yuan Q, Li S, Travis GH (2007). “Role of LRAT on the Retinoid Isomerase Activity and Membrane Association of Rpe65”. 《Journal of Biological Chemistry》 (ASBMB) 282 (29): 20915–20924. doi:10.1074/jbc.M701432200. PMC 2747659. PMID 17504753.
- ↑ Oberhauser V, Voolstra O, Bangert A, von Lintig J, Vogt K (2008). “NinaB combines carotenoid oxygenase and retinoid isomerase activity in a single polypeptide”. 《Proceedings of the National Academy of Sciences》 105 (48): 19000–5. Bibcode:2008PNAS..10519000O. doi:10.1073/pnas.0807805105. PMC 2596218. PMID 19020100.
- ↑ Chen DL, Wang G, Xu B, Hu KS (2002). “All-trans to 13-cis retinal isomerization in light-adapted bacteriorhodopsin at acidic pH”. 《Journal of Photochemistry and Photobiology B: Biology》 66 (3): 188. doi:10.1016/S1011-1344(02)00245-2.
- ↑ “The Nobel Prize in Physiology or Medicine 1967”. Nobelprize.org. 2014년 12월 22일에 확인함.
외부 링크
[편집]- (영어) 레티날