Sodyum borhidrür
| |||
| |||
| Adlandırmalar | |||
|---|---|---|---|
Sodyum tetrahidroborat (1–) | |||
Sodium boranuide | |||
| Tanımlayıcılar | |||
| |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.037.262 | ||
| EC Numarası |
| ||
| 23167 | |||
| MeSH | Sodium+borohydride | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
| UN numarası | 1426 | ||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
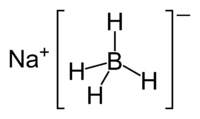
| Molekül formülü | Na[BH 4] | ||
| Molekül kütlesi | 37,83 g/mol | ||
| Görünüm | beyaz kristal | ||
| Koku | kokusuz | ||
| Yoğunluk | 1,0740 g/cm3 | ||
| Erime noktası | 400 °C (752 °F; 673 K) (bozunur) | ||
| Kaynama noktası | 500 °C (932 °F; 773 K) | ||
| Çözünürlük (su içinde) | 550 g/L[1] | ||
| Çözünürlük | sıvı içinde çözünür amonyak, aminler, piridin | ||
| Yapı[2] | |||
| Kübik (NaCl), cF8 | |||
| Fm3m, No. 225 | |||
a = 0,6157 nm
| |||
| Termokimya[3] | |||
Isı sığası (C)
|
86,8 J·mol−1·K−1 | ||
Standart molar entropi (S⦵298)
|
101,3 J·mol−1·K−1 | ||
Standart formasyon entalpisi (ΔfH⦵298)
|
-188,6 kJ·mol−1 | ||
Gibbs serbest enerjisi (ΔfG⦵)
|
-123,9 kJ·mol−1 | ||
| Tehlikeler | |||
| GHS etiketleme sistemi: | |||
| Tehlike ifadeleri | H260, H301, H311, H314 | ||
| Önlem ifadeleri | P223, P231, P232, P280, P301+P310, P370+P378, P422 | ||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | 70 °C (158 °F; 343 K) | ||
| ca. 220 °C (428 °F; 493 K) | |||
| Patlama sınırları | %3 | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
160 mg/kg (Oral – Sıçan) 230 mg/kg (Dermal – Tavşan) | ||
| Benzeyen bileşikler | |||
Diğer anyonlar
|
Boraks Sodyum borat Sodyum hidrür Sodyum siyanoborohidrür | ||
Diğer katyonlar
|
Lityum borohidid | ||
Benzeyen bileşikler
|
Lityum alüminyum hidrid | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Sodyum borhidrür, olarak da bilinen sodyum tetrahidridoborat ve sodyum tetrahidroborat,[4] NaBH4 formülüne sahip olan inorganik bir bileşiktir. Genellikle beyaz toz halinde olarak bulunur, kimya dalında hem laboratuvar hem de teknik ölçekde çok yönlü bir indirgeme ajanı olarak kullanılır. Odundan hamur hazırlamada test edilmiştir ancak ticari maliyeti çok yüksek çıkmıştır.[5] Bileşik olarak alkolde ve bazı eterlerde çözünür. Suyla ise baz yoksunluğunda reaksiyona girer.[6]
Bileşik 1940'larda H. I. Schlesinger tarafından, başında bulunduğu ekiple beraber metal borhidrürler kapsamında savaş zamanı uygulamaları deneyleriyle keşfedilmiştir. 1953'te bu çalışmasını açıklayıp yayınlamıştır.[7]
Özellikleri
[değiştir | kaynağı değiştir]| Solvent | Çözünebilirlik (g/100 mL)[6] |
|---|---|
| MeOH | 13 |
| EtOH | 3.16 |
| Diglyme | 5.15 |
| Et2O | çözünmez |
Sodyum borhidrür kokusuz gri-beyaz toz halinde mikrokristalin yapıdadır. Sıcak(50 °C) haldeki diglyme ile tekrar kristallendirilerek saf halde elde edilebilir. Protik solventlerde, suda ve düşük alkollerde çözünebilir ve hidrojen gazı açığa çıkarır. Bu reaksiyon yavaş gerçekleşir. Metanolle reaksiyonunda çözünmesi 20 °C'de 90 dakika sürer. Nötral veya asidik çözeltilerle çözülebilir ve pH'ı sabit kalır. Bu durumlar da sodyum borhidrürün stabil davranışından faydalanılır ve tepkimeye girme isteğini arttırarak çözünme süresi hızlandırılır.
Sentezi
[değiştir | kaynağı değiştir]Schlesinger metoduyla sodyum borhidrür üretimini sodium hidrürün trimetilborat ile 250–270 °C'de reaksiyona girmesiyle oluşur.
- B(OCH3)3 + 4 NaH → NaBH4 + 3 NaOCH3
Bayer prosesi ile de susuz boraks, sodyum metali ve kuartz, 3 atm hidrojen basıncı altında, 500 °C'de karıştırıcılı otoklavla 2 ile 4 saat arasında ısıtılır. Reaksiyon ürününün amonyak ile ekstraksiyonundan ve amonyağın evaporasyonundan sonra yüksek bir verimle NaBH4 elde edilir. Yan ürün olarak da sodyum metasilikat oluşur.
- 1/4 Na2 B4O7 + 4Na + 2H2 + 7/4 SiO2 → NaBH4 + 7/4 Na2SiO3
Kullanım Alanları
[değiştir | kaynağı değiştir]Sülfür dioksit ile beraber kullanılarak sodyum hidrosülfit üretiminde kullanılır. Sodyum hidrosülfit boya sektöründe ağaç hamurunu ağartma ajanı olarak kullanılmaktadır.
Sodyum borhidrürler aldehit ve ketonlarla indirgenerek alkolleri verir. Bu reaksiyon çeşitli antibiyotikleri içerikleri üretmede kullanılır. Çeşitli steroidlerin ve vitamin A'nın sentezinin bir aşamasında da sodyum borhidrür kullanılmaktadır.
Sodyum bor hidrür ayrıca altın nanoparçacık üretiminde indirgeme ajanı olarak kullanılır.
En önemli kullanım alanı ise yapısında hidrojen bulundurmasından dolayı hidrojen depolayıcı olarak kullanılmasıdır. Uygun basınç ve sıcaklık aralığında nanoyapıda hidrojen depolanabilir ve bunun saklanması kolayca sağlanabilir.[8]
Kaynakça
[değiştir | kaynağı değiştir]- ^ Kaynak hatası: Geçersiz
<ref>etiketi;crcisimli refler için metin sağlanmadı (Bkz: Kaynak gösterme) - ^ Ford, P. T. and Powell, H. M. (1954). "The unit cell of potassium borohydride, KBH4, at 90° K". Acta Crystallogr. 7 (8): 604-605. doi:10.1107/S0365110X54002034
 .
.
- ^ CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th bas.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942. 4 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ağustos 2023.
- ^ Busch, D.H. (2009). Inorganic Syntheses. 20. Wiley. s. 137. ISBN 9780470132869. 6 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Mayıs 2015.
- ^ Istek, A. and Gonteki, E. "Utilization of sodium borohydride (NaBH4) in kraft pulping process." Retrieved online on 25 September 2014 at http://www.jeb.co.in/journal_issues/200911_nov09/paper_05.pdf 3 Mart 2016 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ a b Banfi, L.; Narisano, E.; Riva, R.; Stiasni, N.; Hiersemann, M. "Sodium Borohydride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289X.rs052.
- ^ Schlesinger, H. I.; Brown, H. C.; Abraham, B.; Bond, A. C.; Davidson, N.; Finholt, A. E.; Gilbreath, J. R.; Hoekstra, H.; Horvitz, L.; Hyde, E. K.; Katz, J. J.; Knight, J.; Lad, R. A.; Mayfield, D. L.; Rapp, L.; Ritter, D. M.; Schwartz, A. M.; Sheft, I.; Tuck, L. D.; Walker, A. O. (1953). "New developments in the chemistry of diborane and the borohydrides. General summary". J. Am. Chem. Soc. Cilt 75. ss. 186-90. doi:10.1021/ja01097a049.
- ^ Stuart Gary, "Hydrogen storage no longer up in the air 7 Nisan 2017 tarihinde Wayback Machine sitesinde arşivlendi." in ABC Science 16 August 2012, citing Christian, Meganne; Aguey-Zinsou, Kondo François (2012). "Core–Shell Strategy Leading to High Reversible Hydrogen Storage Capacity for NaBH4". ACS Nano. American Chemical Society. doi:10.1021/nn3030018. 25 Mayıs 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Ağustos 2012.

