Elektroforez
Elektroforez, bir elektrik alanın etkisi altında yüklü parçacıkların (iyonların) göçünü ve ayrılmasını tanımlayan genel bir terimdir. Bu teknoloji, nükleik asitlerin ayrıştırılması ve analizi için önem taşımaktadır. Nükleik asitlerin elektroforezi, klonlanmış DNA fragmanlarının izolasyonu ve manipülasyonu için laboratuvar tezgahında rutin olarak kullanılmaktadır. Ek olarak, nükleik asitlerin hücrelerdeki ve dokulardaki rolünü ve etkileşimini değerlendiren birçok moleküler biyoloji protokolünün kritik bir bileşenidir. Nükleik asit elektroforezi, mevcut genom dizileme çağında özel bir önem kazanmıştır. Bu uygulama, nükleik asit analizinin hızı ve doğruluğunu yansıtacak şekilde gelişmiştir.[1]
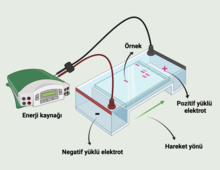
Elektroforez, proteinlerin, DNA karbonhidratlarının ve diğer biyomoleküllerin ayrılması ve analizi için önemli bir analitik tekniktir. Moleküler biyolojide kullanılan birçok teknik için temel bir önkoşuldur ve kromatografi ve spektroskopinin yanı sıra laboratuvarda temel bir prosedürdür. Bununla birlikte, halihazırda oldukça karmaşık ve otomatik olan bu diğer iki tekniğin aksine, elektroforez manuel ve yoğun emek gerektirir.[2]
Geçmişi
[değiştir | kaynağı değiştir]Elektrokinetik elektroforez fenomeni ilk kez 1807'de Moskova Üniversitesi'nden Rus profesörler Peter Ivanovich Strakhov ve Ferdinand Frederic Reuss tarafından gözlemlenmiştir. Sabit bir elektrik alanı uygulamasının suda dağılmış kil parçacıklarının göç etmesine neden olduğunu fark etmişler. Bu nedenle de molekülleri boyut, yük veya bağlanma afinitesine göre ayırmak için bu tekniğin temelini koymuşlar.[3] Moleküler ayırma ve kimyasal analiz için kullanılan elektroforez tekniğinin tarihi, 1931'de Arne Tiselius'un çalışmasıyla başlarken, 21. yüzyılda elektroforeze dayalı yeni ayırma süreçleri ve kimyasal analiz teknikleri geliştirilmeye devam ediyor. Rockefeller Vakfı'nın desteğiyle Tiselius, 1937'de tanınmış "Kolloidal Karışımların Elektroforetik Analizi için Yeni Bir Cihaz" adlı makalede açıklanan sınır elektroforezini hareket ettirmek için "Tiselius aparatını" geliştirdi. Yöntem, destekleyici ortam olarak filtre kağıdı veya jellerin kullanıldığı 1940'larda ve 1950'lerde etkili bölge elektroforez yöntemlerinin ortaya çıkmasına kadar yavaşça yayıldı. 1960'lara gelindiğinde, giderek daha karmaşık hale gelen jel elektroforez yöntemleri, biyolojik molekülleri en küçük fiziksel ve kimyasal farklılıklara göre ayırmayı mümkün kılarak moleküler biyolojinin yükselişine yardımcı oldu.[4]
Mekanizma
[değiştir | kaynağı değiştir]Bir elektroforetik sistem, elektrolit adı verilen iletken bir ortamla birbirine bağlanan iki zıt yüklü elektrottan (anot, katot) oluşmaktadır. İyonik parçacıklar üzerindeki ayırma etkisi, parçacığın hareketliliğinin (m) ve alan kuvvetinin (E) ürünü olan hızlarındaki (v) farklılıklardan kaynaklanır: v=mE. Bir iyonik partikülün hareketliliği (m), partikül boyutu, şekli, yükü ve ayırma sırasındaki sıcaklık ile belirlenmektedir. İyonik partikülün hareketliliği, sürekli olarak tanımlanan elektroforetik koşullar altındadır. Elektroforetik koşullar, elektriksel parametreler (akım, voltaj, güç) ve iyonik kuvvet, pH değeri, viskozite, gözenek boyutu gibi faktörlerle karakterize edilir. Bu faktörler, partiküllerin içinde hareket ettiği ortamı tanımlamaktadır.[5] Örneğin, DNA, negatif yüklü bir moleküldür ve bu nedenle, bir elektrolit çözeltisindeki bir elektrik alanı varlığında pozitif anoda doğru hareket eder ve diferansiyel hareketlilik, boyuta göre belirlenmektedir.
Genetik
[değiştir | kaynağı değiştir]Elektroforez, enzim polimorfizmlerinin tek boyutlu elektroforezinden, insan genomu projesinde DNA elektroforezinin kullanımına kadar, tüm insan genomunun dizilenmesiyle sonuçlanan genetik çalışmasında önemli gelişmeleri kolaylaştırmıştır. DNA fragmanlarının jel elektroforezi günümüzde insan sağlığını etkileyen genetik kusurların araştırılmasında yaygın olarak kullanılmaktadır ve moleküler düzeyde kalıtsal hastalığın anlaşılmasında önemli gelişmelere yol açmıştır. Baz dizisindeki mutasyonlar ayrıca sınırlama nükleazları tarafından bozunmada oluşan fragmanların boyutunda değişikliklere yol açabilir. Uygun olduğunda, spesifik genler (DNA fragmanları), polimeraz zincir reaksiyonu (PCR) 15 Mayıs 2021 tarihinde Wayback Machine sitesinde arşivlendi. ile hedeflenebilir ve amplifiye edilebilir.
Proteinlerin elektroforetik olarak ayrılması (gen ürünleri ve bunların translasyon sonrası modifikasyonları), genetik polimorfizmler ve kalıtsal hastalıkların incelenmesinde önemli bir araç olmaya devam etmektedir. İlgi konusu proteinler için saptama yöntemleri arasında protein boyama, zimogramlar, Western blotlama ve izotopik etiketleme yer almaktadır. Çoğu durumda, mutant genin ürünü bilinmemektedir. Bu gibi durumlarda, ilgili geni klonlamak ve ürününü, yani "gruplanmış" olarak karakterize etmek artık mümkündür.[6]
Kaynakça
[değiştir | kaynağı değiştir]- ^ Encyclopedia of Analytical Science (PDF). 2005. 15 Mayıs 2021 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 15 Mayıs 2021.
- ^ Fluorescent and Luminescent Probes for Biological Activity (Second Edition). 1999. 15 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Mayıs 2021.
- ^ "Sur un nouvel effet de l'électricité galvanique". Mémoires de la Société Impériale des Naturalistes de Moscou. 1809. 15 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Mayıs 2021.
- ^ "A new apparatus for electrophoretic analysis of colloidal mixtures". Transactions of the Faraday Society. 1937. 10 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Mayıs 2021.
- ^ Encyclopedia of Food Sciences and Nutrition (Second Edition). 2003. 18 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Mayıs 2021.
- ^ Encyclopedia of Analytical Science (Second Edition). 2005. 28 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Mayıs 2021.