Tryptofán-2,3-dioxygenáza
 Kryštálová štruktúra ľudskej tryptofán-2,3-dioxygenázy v komplexe s tryptofánom. Hem a väzbové aminokyseliny sú zvýraznené zelenou farbou, tryptofán tyrkysovou farbou. | |
| Identifikátory | |
|---|---|
| Číslo EC | EC 1.13.11.11 |
| Číslo CAS | 9014-51-1 |
| Databázy | |
| IntEnz | hľadať v IntEnz |
| BRENDA | hľadať v BRENDA |
| ExPASy | hľadať v ExPASy |
| KEGG | hľadať v KEGG |
| MetaCyc | hľadať v MetaCyc |
| PDB štruktúry | RSCB PDB PDBe PDBsum |
Tryptofán-2,3-dioxygenáza (TDO, EC 1.13.11.11) je hemový enzým, ktorý katalyzuje oxidáciu L-tryptofánu (L-Trp) na N'-formylkynurenín pomocou molekulárneho kyslíku:
- tryptofán + O2 → N'-formylkynurenín
Tryptofán-2,3-dioxygenáza hrá kľúčovú úlohu v regulácii fyziologického toku tryptofánu v ľudskom tele, keďže je súčasťou metabolizmu tryptofánu. TDO katalyzuje prvú reakciu a zároveň rýchlosť určujúci krok rozkladu tryptofánu prostredníctvom kynurenínovej dráhy, čím reguluje hladinu tryptofánu v organizme.[1]
U ľudí je tento enzým kódovaný génom TDO2.[2]
Funkcia
[upraviť | upraviť zdroj]TDO patrí medzi oxidoreduktázy, konkrétne tie, ktoré pôsobia na jednu molekulu, využívajú O2 ako oxidant a zabudovávajú dva atómy kyslíka do substrátu (patrí teda medzi dioxygenázy). Niekedy sa enzým nazýva i tryptofándioxygenáza, tryptofánoxygenáza alebo tryptofánpyroláza.[3]
TDO katalyzuje prvú reakciu rozkladu tryptofánu, pri ktorej sa tryptofán mení na N'-formylkynurenín. V procese dochádza k štiepeniu pyrolového kruhu indolu pomocou molekulárneho kyslíka:[3][4]
- tryptofán + O2 → N'-formylkynurenín
N'-formylkynurenín sa ďalej premieňa pôsobením kynurenínformamidázy na kynurenín.[4]
TDO bola pôvodné objavená v 30. rokoch 20. storočia[5] a nachádza sa u prokaryotov i eukaryotov. Expresia TDO u cicavcov prebieha normálne len v pečeni, ale u niektorých druhov bola identifikovaná i v mozgu a nadsemenníkoch a u niektorých tkanív je možné ju indukovať na základe rôznych podnetov.[6] Krysia TDO bola ako prvá exprimovaná rekombinantne (v E. coli),[7] neskôr bola rekombinantne exprimovaná i ľudská TDO.[8][9]
Príbuzné enzýmy
[upraviť | upraviť zdroj]TDO je funkčne príbuzná s enzýmom indolamín-2,3-dioxygenázou (IDO).[6][10] TDO je zvyčajne tetramér, zatiaľ čo IDO je monomérny enzým. TDO i IDO obsahujú jeden nekovalentne viazaný hem na podjednotku.
Do tej istej rodiny enzýmov k TDO patrí i IDO zo Shewanella oneidensis[11] a PrnB, druhý enzým v biosyntetickej dráhe pyrolnitrínu z Pseudomonas fluorescens,[12] i keď u PrnB nebola pozorovaná dioxygenázová aktivita. V roku 2007 bol objavený nový enzým schopný dioxygenácie tryptofánu, IDO2. [13]
Štruktúra
[upraviť | upraviť zdroj]TDO je cytozolový enzým obsahujúci hem, ktorý je kódovaný génom TDO2.[1] Kryštalografické štúdie TDO z Xanthomonas campestris[11] a Talstonia metallidurans[14] ukázali, že ich štruktúry sú prakticky identické a existujú v podobe homotetramérov.[15] Presnejšie ide o dimér dimérov, pretože N-koncové aminokyseliny každého monoméru tvoria väzbové miesto pre substrát z vedľajšieho monoméru. Tieto bielkoviny sa skladajú z helixov a poblíž aktívneho miesta sa nachádza flexibilný ohyb, ktorý sa účastní (nekovalentnej) väzby s tryptofánom. Tento ohyb je evidentne indukovaný naviazaním tryptofánu, pretože sa nachádza len v kryštáloch, v ktorých je prítomný i tryptofán.[15]
Sú dostupné minimálne dve štruktúry TDO, v ktorých je naviazaný tryptofán.[15][16]
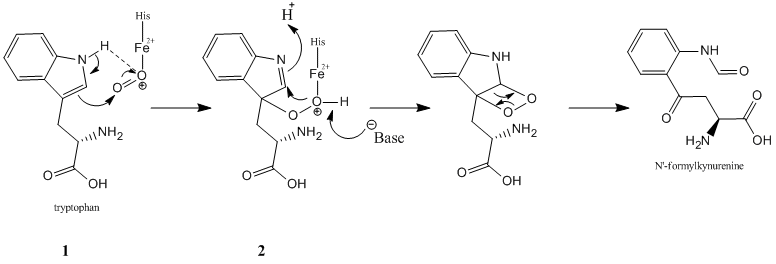
Mechanizmus
[upraviť | upraviť zdroj]Prvé návrhy reakčného mechanizmu oxidácie tryptofánu pochádzajú od Sona a Dawsona.[17] Navrhli, že ide o abstrakciu protónu katalyzovanú zásadou a že nedochádza k oxidácii hemu (ostáva teda ako FeII). Predpokladá sa, že TDO a IDO majú rovnaký reakčný mechanizmus, aj keď pre to neexistuje konkrétny dôkaz. U IDO však bol identifikovaný FeIV hem počas reakcie.[18][19] Návrhy reakčného mechanizmu boli upravené tak, aby zahŕňali i tento oxidačný stav železa.[20] Predpokladá sa, že reakcia katalyzovaná TDO prebieha rovnako, ale FeIV hem nebol u TDO pozorovaný.
Klinický význam
[upraviť | upraviť zdroj]Bolo ukázané, že TDO sa exprimuje vo významnom množstve v ľudských nádoroch.[1] V tej istej štúdií sa ukázalo, že expresia TDO nádormi pomáhala proti odmietnutiu imunizovanými myšami. TDO inhibítor, ktorý bol vyvinutý touto výskumnou skupinou, znovu umožnil myšiam odmietnuť nádory exprimujúce TDO, čo naznačuje, že inhibítory TDO by mohli pomôcť v liečbe rakoviny.
Iná štúdia ukázala, že TDO sa potenciálne účastní metabolickej dráhy zodpovednej za správanie súvisiace s úzkosťami.[21] Vytvorením myší, ktoré exprimovali nižšie množstvo TDO, a ich porovnaním s normálnymi myšami sa podarilo výskumnej skupine ukázať, že myši s nižšou hladinou TDO mali nielen vyššiu hladinu tryptofánu v plazme, ale i vyššiu hlasinu serotonínu a 5-HIAA v hipokampe a strednom mozgu. Rôzne skúšky ukázali, že u myší s nižšou expresiou TDO dochádza k anxiolytickej modulácii, čo poukazuje na priame spojenie medzi TDO a metabolizmom tryptofánu so správaním súvisiacim s uzkosťami pri fyziologických podmienkach.
Referencie
[upraviť | upraviť zdroj]- ↑ a b c Reversal of tumoral immune resistance by inhibition of tryptophan 2,3-dioxygenase. Proceedings of the National Academy of Sciences of the United States of America, February 2012, s. 2497–2502. DOI: 10.1073/pnas.1113873109. PMID 22308364.
- ↑ Entrez Gene: TDO2 tryptophan 2,3-dioxygenase [online]. . Dostupné online.
- ↑ a b DOBROTA, Dušan, a kol. Lekárska biochémia. 2. vyd. Martin : Osveta, 2016. 799 s. ISBN 978-80-8063-444-5. S. 295 – 298.
- ↑ a b VOET, Donald. Biochemistry. 4th ed. Hoboken, NJ : John Wiley & Sons, 2011. ISBN 978-0-470-57095-1. S. 1041 – 1042.
- ↑ Über den Mechanismus der Kynureninbildung aus Tryptophan. Z. Physiol. Chem., 1936, s. 237–244. DOI: 10.1515/bchm2.1936.243.6.237.
- ↑ a b Indoleamine 2,3-dioxygenase and tryptophan 2,3-dioxygenase. Handbook of Metalloproteins, 2008. DOI: 10.1002/0470028637.met223.
- ↑ Expression of rat liver tryptophan 2,3-dioxygenase in Escherichia coli: structural and functional characterization of the purified enzyme. Archives of Biochemistry and Biophysics, September 1996, s. 96–102. DOI: 10.1006/abbi.1996.0368. PMID 8806758.
- ↑ Human tryptophan dioxygenase: a comparison to indoleamine 2,3-dioxygenase. Journal of the American Chemical Society, December 2007, s. 15690–15701. DOI: 10.1021/ja076186k. PMID 18027945.
- ↑ A kinetic, spectroscopic, and redox study of human tryptophan 2,3-dioxygenase. Biochemistry, April 2008, s. 4752–4760. DOI: 10.1021/bi702393b. PMID 18370401.
- ↑ Structure and reaction mechanism in the heme dioxygenases. Biochemistry, April 2011, s. 2717–2724. DOI: 10.1021/bi101732n. PMID 21361337.
- ↑ a b Molecular insights into substrate recognition and catalysis by tryptophan 2,3-dioxygenase. Proceedings of the National Academy of Sciences of the United States of America, January 2007, s. 473–478. DOI: 10.1073/pnas.0610007104. PMID 17197414.
- ↑ The second enzyme in pyrrolnitrin biosynthetic pathway is related to the heme-dependent dioxygenase superfamily. Biochemistry, October 2007, s. 12393–12404. DOI: 10.1021/bi7012189. PMID 17924666.
- ↑ Characterization of an indoleamine 2,3-dioxygenase-like protein found in humans and mice. Gene, July 2007, s. 203–213. DOI: 10.1016/j.gene.2007.04.010. PMID 17499941.
- ↑ Crystal structure and mechanism of tryptophan 2,3-dioxygenase, a heme enzyme involved in tryptophan catabolism and in quinolinate biosynthesis. Biochemistry, January 2007, s. 145–155. DOI: 10.1021/bi0620095. PMID 17198384.
- ↑ a b c Exploring the mechanism of tryptophan 2,3-dioxygenase. Biochemical Society Transactions, December 2008, s. 1120–1123. DOI: 10.1042/bst0361120. PMID 19021508.
- ↑ Molecular basis for catalysis and substrate-mediated cellular stabilization of human tryptophan 2,3-dioxygenase. Scientific Reports, October 2016, s. 35169. DOI: 10.1038/srep35169. PMID 27762317.
- ↑ Heme-Containing Oxygenases. Chemical Reviews, November 1996, s. 2841–2888. DOI: 10.1021/cr9500500. PMID 11848843.
- ↑ Evidence for a ferryl intermediate in a heme-based dioxygenase. Proceedings of the National Academy of Sciences of the United States of America, October 2009, s. 17371–17376. DOI: 10.1073/pnas.0906655106. PMID 19805032.
- ↑ Identification of the Fe-O2 and the Fe=O heme species for indoleamine 2,3-dioxygenase during catalytic turnover. Chem Lett, 2010, s. 36–37. Dostupné online. DOI: 10.1246/cl.2010.36.
- ↑ The mechanism of formation of N-formylkynurenine by heme dioxygenases. Journal of the American Chemical Society, October 2011, s. 16251–16257. DOI: 10.1021/ja207066z. PMID 21892828.
- ↑ Tryptophan 2,3-dioxygenase is a key modulator of physiological neurogenesis and anxiety-related behavior in mice. Molecular Brain, March 2009, s. 8. DOI: 10.1186/1756-6606-2-8. PMID 19323847.
Ďalšia literatúra
[upraviť | upraviť zdroj]- Human tryptophan oxygenase localized to 4q31: possible implications for alcoholism and other behavioral disorders. Genomics, February 1991, s. 301–308. DOI: 10.1016/0888-7543(91)90257-F. PMID 2004780.
- Sequence of human tryptophan 2,3-dioxygenase (TDO2): presence of a glucocorticoid response-like element composed of a GTT repeat and an intronic CCCCT repeat. Genomics, September 1995, s. 390–396. DOI: 10.1006/geno.1995.9990. PMID 8666386.
- Structure--function relationships of rat hepatic tryptophan 2,3-dioxygenase: identification of the putative heme-ligating histidine residues. Archives of Biochemistry and Biophysics, August 2001, s. 71–78. DOI: 10.1006/abbi.2001.2420. PMID 11469796.
- Decreased tryptophan catabolism by placental indoleamine 2,3-dioxygenase in preeclampsia. American Journal of Obstetrics and Gynecology, March 2003, s. 719–726. DOI: 10.1067/mob.2003.156. PMID 12634647.
- Association of tryptophan 2,3 dioxygenase gene polymorphism with autism. American Journal of Medical Genetics. Part B, Neuropsychiatric Genetics, February 2004, s. 63–68. DOI: 10.1002/ajmg.b.20147. PMID 14755447.
- Expression of indoleamine 2,3-dioxygenase and production of quinolinic acid by human microglia, astrocytes, and neurons. Glia, January 2005, s. 15–23. DOI: 10.1002/glia.20090. PMID 15390107.
- Differentiation of human embryonic stem cells into hepatocytes in 2D and 3D culture systems in vitro. The International Journal of Developmental Biology, 2006, s. 645–652. DOI: 10.1387/ijdb.052072hb. PMID 16892178.
- Human tryptophan dioxygenase: a comparison to indoleamine 2,3-dioxygenase. Journal of the American Chemical Society, December 2007, s. 15690–15701. DOI: 10.1021/ja076186k. PMID 18027945.
- EPR and Mossbauer spectroscopy show inequivalent hemes in tryptophan dioxygenase.. Journal of the American Chemical Society, 2007, s. 1098–1109. DOI: 10.1021/ja908851e. PMID 20047315.
- Developments in Tryptophan and Serotonin Metabolism. [s.l.] : [s.n.], 2003. ISBN 978-1-4613-4939-6. DOI:10.1007/978-1-4615-0135-0_56 Tryptophan Metabolism Along the Kynurenine Pathway in Rats, s. 481–496.
- Density functional theory study on a missing piece in understanding of heme chemistry: the reaction mechanism for indoleamine 2,3-dioxygenase and tryptophan 2,3-dioxygenase. Journal of the American Chemical Society, September 2008, s. 12299–12309. DOI: 10.1021/ja803107w. PMID 18712870.
- Developments in Tryptophan and Serotonin Metabolism. [s.l.] : [s.n.], 2003. ISBN 978-1-4613-4939-6. DOI:10.1007/978-1-4615-0135-0_55 Tryptophan Metabolism in Rabbits, s. 473–479.
Pozri aj
[upraviť | upraviť zdroj]Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Tryptophan 2,3-dioxygenase na anglickej Wikipédii.