Rhinella marina
| Sapo de caña | ||
|---|---|---|
 Macho adulto | ||
 Hembra adulta | ||
| Estado de conservación | ||
 Preocupación menor (UICN 3.1)[1] | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Subfilo: | Vertebrata | |
| Superclase: | Tetrapoda | |
| Clase: | Amphibia | |
| Orden: | Anura | |
| Familia: | Bufonidae | |
| Género: | Rhinella | |
| Especie: |
R. marina Linnaeus, 1758 | |
| Distribución | ||
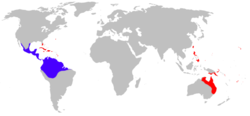 Distribución de R. marina. Distribución nativa en azul, introducida en rojo. | ||
| Sinonimia | ||
| ||
El sapo gigante o sapo de caña (Rhinella marina)[3] también conocido como sapo neotropical gigante o sapo marino, es una especie de anfibio anuro de la familia Bufonidae.
Este anfibio tiene grandes glándulas venenosas; los adultos y renacuajos al ser ingeridos son altamente tóxicos para la mayoría de los animales. El sapo de caña es grande y terrestre, mide en promedio de 10 a 15 cm; el espécimen más grande registrado pesó 2,65 kg y alcanzó 38 cm de hocico a cloaca y 54 cm totalmente extendido.[4]
Su piel seca y verrugosa tiene distintas protuberancias que comienzan encima de los ojos y terminan en el hocico. Puede ser gris, marrón, rojo-marrón u oliva. Con gran glándula parotoide detrás de cada ojo. Vientre color crema y a veces manchas en sombras de negro o marrón. Pupilas horizontales con iris dorado. Dedos del pie con membranas carnosas en su base, los dedos de la mano son libres. Este sapo es miembro del género Rhinella con decenas de especies de sapos en diferentes hábitats en América.[3] Está incluido en la lista 100 de las especies exóticas invasoras más dañinas del mundo,[5] de la UICN. Es nativo de América, desde el valle del Río Bravo en el norte de México hasta el Amazonas central y sudeste de Perú. Este rango incluye ambientes tropical y semiárido.[6] En México se distribuye a lo largo de las vertientes del Pacífico y del Golfo hasta alcanzar la Península de Yucatán. Dado su voraz apetito, se ha introducido particularmente en regiones de islas Pacíficas y Caribeñas como método agrícola de control de plagas (notable en el caso de Australia en 1935[¿Por qué?]). Deriva su nombre común de su uso contra las plagas de la caña de azúcar, pero ahora es considerado una plaga en muchas de las regiones donde fue introducido, ya que la toxicidad de su piel mata a los depredadores nativos cuando es comido.[3] El sapo de caña es una especie antigua; un fósil de sapo Bufonidae, el ejemplar "UCMP 41159" encontrado en depósitos del Mioceno (hace trece millones de años) en la zona de La Venta, Colombia, es prácticamente indistinguible de la especie moderna,[7] siendo hallados sus restos en depósitos de planicies de inundación, lo que indica la antigua preferencia de la especie por áreas abiertas.[8] Asimismo, recientemente se han encontrado restos fósiles en la ciudad de Temuco en Chile. Actualmente, se conocen 89 especies vivas del género de sapos Rhinella, grupo que cuenta con una amplia distribución en América, pero cuyo registro fósil es escasísimo, por lo que se conoce muy poco de sus antepasados[9]. Es un reproductor prolífico; las hembras depositan un solo grupo, desovando gran número de huevos. Su éxito reproductor es en parte debido al alimento oportuno; tienen una dieta, rara entre los anuros, de ambas, materia viva y muerta. La UICN2019-1 considera a la especie como de preocupación menor.[3]
Taxonomía
[editar]El nombre común de "sapo de caña" se deriva del propósito original de usarlo para erradicar las plagas de cosechas de cañas de azúcar. Tiene muchos otros nombres comunes, incluyendo "sapo gigante" y "sapo marino"; el primero se refiere a su tamaño, y el siguiente a su nombre binomial, Rhinella marina. El epíteto específico, marinus, fue escogido por Carlos Linneo, quien se basó en una ilustración de Albertus Seba. Seba creyó erróneamente que el sapo de caña habitó en ambos ambientes, terrestre y marino.[10] Otros nombres comunes incluyen "sapo neotropical gigante", "sapo dominicano", "sapo marino gigante", y "sapo sudamericano de caña".
En Australia, los adultos suelen ser confundidos con especies de los géneros Limnodynastes, Neobatrachus, Mixophyes y Notaden. Aunque estas especies se pueden distinguir rápidamente del sapo de caña por la falta de grandes glándulas parotoides detrás de sus ojos. También se los confunde con la rana excavadora gigante (Heleioporus australiacus), porque en apariencia ambos son grandes y verrugosos; sin embargo, la rana excavadora gigante se diferencia de estos por sus pupilas verticales. Sapos de caña juveniles son asociados con especies del género Uperoleia, porque todos ellos tienen glándulas parotoides; pero los sapos de caña juveniles son fácilmente distinguibles de estos por las protuberancias alrededor de sus ojos y la carencia de color claro en sus muslos.[11]
En los Estados Unidos, es morfológicamente similar a muchas especies de la familia Bufonidae. En particular, podría ser confundido con el sapo meridional (Anaxyrus terrestris) y el sapo de Fowler (Anaxyrus fowleri). Aunque el sapo meridional se distingue por la presencia de dos bulbos en frente de las glándulas parotoides, y el sapo de Fowler tiene una pálida raya blanca o crema que corre abajo de la superficie dorsal; el sapo de caña carece de esta raya.
Es posible también que se lo confunda con el sapo rococo (Rhinella schneideri), a veces llamado sapo de Schneider, el cual sobrepasa el área de distribución del sapo de caña. El sapo rococo crece cercanamente hasta el mismo tamaño del sapo de caña, pero se diferencia de este por sus glándulas venenosas adicionales en sus patas traseras con las cuales se lo puede identificar. El sapo de caña, dentro de su rango nativo, puede distinguirse de otros sapos verdaderos por la forma de sus glándulas parotoides, y el orden de las protuberancias en su cabeza.
Descripción física
[editar]
El sapo de caña es muy grande, alcanzando una longitud promedio de 10 a 15 cm, y en algunos casos mucho más grande. "Prinsen", un espécimen guardado como mascota en Suecia, está listado por el Libro Guinness de los Récords como el más grande registrado, con un peso de 2.65 kg y un largo de 38 cm desde el hocico hasta la cloaca, o 54 cm totalmente extendido.[4] Otro ejemplar, preservado en el museo de Queensland, medía 24,1 cm de largo, 16,5 cm de ancho y pesaba 1,36 kg.[12] A fines de noviembre de 2019 fue encontrado en la provincia de Santa Fe, en Argentina, un espécimen de alrededor de 25 cm y 2 kg de peso.[13] En 2023 se encontró un ejemplar en el parque nacional Conway, en Australia, que pesaba 2,7 kilos.[14] En estado salvaje tienen una esperanza de vida de diez a quince años, mientras que en cautividad pueden llegar hasta los veinte años.
Su piel es seca y verrugosa. Tiene distintas protuberancias que comienzan encima de los ojos y terminan en el hocico. Pueden ser grises, marrones, rojo-marrones u olivas, con patrones que varían. Poseen una gran glándula parotoide detrás de cada ojo. La superficie ventral es crema y puede tener manchas en sombras de negro o marrón. Las pupilas son horizontales y las irises doradas. Los dedos del pie tienen membranas carnosas en su base, mientras los dedos de la mano son libres.
Los sapos de caña juveniles son muchísimo más pequeños que los adultos (solamente de 5 a 10 mm de largo). Típicamente son lisos, de piel oscura, aunque algunos la tienen roja. Carecen de las grandes glándulas parotoides de los adultos, por lo que normalmente son menos venenosos. Se estima que solo un 0,5 % de los pequeños alcanzan la madurez.[15] Los renacuajos son pequeños y uniformemente negros. Son habitantes del fondo marino y se congregan alrededor de las plantas formando enjambres. Los renacuajos alcanzan 27 mm de longitud, pero en condiciones de atestamientos son más pequeños, con un máximo de 22 mm.
Ecología y comportamiento
[editar]Los sapos de caña adultos poseen glándulas parotoides alargadas detrás de los ojos, y otras glándulas que le recorren la espalda. Cuando se sienten amenazados, segregan un fluido blanco alcaloide, conocido como bufotoxina, que contiene componentes que resultan tóxicos para muchos animales. Incluso, se han reportado muertes de seres humanos,[16] intoxicados al tratar de capturarlos y consumirlos. Un sapo de caña es también capaz de inflar sus pulmones, alzando su cuerpo para parecer más grande ante un depredador.
Muchas ranas identifican una presa por sus movimientos; los sapos de caña pueden además localizar comida usando su sentido del olfato. No se limitan por consiguiente a cazar presas y pueden comer plantas, carroña, comida de perros y desechos, aparte de la alimentación normal de las ranas, basada en vertebrados pequeños e invertebrados.
El nombre común de "sapo marino", y el nombre científico Rhinella marina, sugieren un enlace con la vida marina; sin embargo no hay tal enlace. Los adultos son completamente terrestres, aventurándose en el agua dulce solo para reproducirse. Sin embargo, experimentos de laboratorio muestran que los renacuajos pueden tolerar concentraciones salinas equivalentes al 15 % del agua de mar (~5.4 ‰),[17] y observaciones de campo recientes encontraron renacuajos y juveniles viviendo en salinidades de 27,5 ‰ en la Isla de Coiba, Panamá.[18] Ambos, huevos y renacuajos son tóxicos para muchos animales. Esta protección tóxica la pierden por un tiempo después de la metamorfosis, hasta el desarrollo de las glándulas parotoides. Los sapos de caña habitan en prados abiertos, generalmente evitando áreas forestales; esto inhibe su extensión en muchas de las regiones en las cuales fueron introducidos.
Muchas especies lo cazan en su distribución nativa. Estas incluyen al yacaré overo (Caiman latirostris), la serpiente con ojos de gato bandados (Leptodeira annulata), la anguila (familia: Anguillidae), varias especies de peces asesinos, la perca de jungla (Kuhila rubestris), algunas especies de pez gato (orden: Siluriformes) y una cuantas especies de ibis (subfamilia: Threskiornithinae). Depredadores fuera del rango nativo del sapo de caña incluyen al milano silbador (Haliastur sphenurus), la rata de agua (Hydromys chrysogastes), la rata negra (Rattus rattus) y el monitor de agua (Varanus salvator). Se han reportado casos ocasionales de aves, como el podargo australiano (Podargus strigoides) y el podargo papú (Podargus papuensis),[19] que se alimentan de estos sapos. Estos depredadores poseen una tolerancia a las toxinas, o tienen adaptaciones del comportamiento que les permiten evitar las áreas más venenosas del animal mientras lo cazan y lo consumen.
Reproducción
[editar]Los machos hacen sus llamados cerca de un manantial para atraer hembras. El llamado es una vibración larga y ruidosa; parecido al sonido de un motor pequeño. Como todos los sapos verdaderos, el macho y la hembra experimentan un amplexo inguinal, en el cual el macho se posa detrás de la hembra, y la agarra alrededor de la cintura. La hembra entonces pone los huevos para que el macho los cubra con esperma.
Las hembras depositan de cuatro mil a treinta y seis mil huevos por desove, y se reproducen por lo menos dos veces al año. Son reproductoras oportunistas, consecuentemente, no tienen ninguna estación específica de reproducción y lo hacen en cualquier lugar con agua suficiente. Los huevos son depositados en largos filamentos, normalmente enredados alrededor de plantas u objetos sumergidos. Son de color negro y están rodeados de una baba transparente gelatinosa de 4 a 5 mm de diámetro. El tiempo que tardan en romperse los huevos depende de la temperatura del agua, variando entre veinticinco horas a 34 °C y ciento cincuenta y cinco a 14 °C. El desarrollo de los renacuajos dura entre doce y sesenta días.
Distribución
[editar]Es nativo de América, desde el valle del río Bravo en el norte de México hasta el Amazonas central y sudeste de Perú. Este rango incluye ambos ambientes, tropical y semiárido. La densidad del sapo de caña dentro de su distribución nativa es significativamente más baja que la de su distribución inducida. En América del Sur, se han registrado densidades de veinte adultos por cada 100 m de litoral, pero en Australia la densidad alcanza de mil a dos mil adultos en la misma área.[6]


Introducciones
[editar]Ha sido introducido en muchas regiones del mundo, particularmente en el Pacífico, para el control biológico de plagas agrícolas. Hasta 1844, habían sido introducidos en Martinica, Barbados y Jamaica, donde fracasaron en el intento de controlar la población de ratas.
También hay poblaciones introducidas en Australia, Florida, Papúa Nueva Guinea, las Filipinas, las Islas Ogasawara y Ryukyu de Japón, la mayoría de las islas caribeñas y muchas del Pacífico, incluyendo Hawái y Fiyi. Las introducciones generalmente fallaron en el control de plagas, muchas de las cuales fueron luego controladas por el uso de insecticidas. Desde entonces, el mismo sapo de caña se ha convertido en una verdadera amenaza para algunas especies nativas. Esto se debe al gran número de especies con las que exitosamente compite, y las grandes áreas de praderas en las que se multiplica.
En 1920, fueron llevados a Puerto Rico para el control de poblaciones de escarabajos de mayo (Phyllophaga sp.), plaga de la caña de azúcar. Por 1932, estaban bien establecidos en la isla, y las poblaciones de escarabajos disminuyeron dramáticamente, lo que fue atribuido al sapo de caña, aunque pudieron haber habido otros factores: por ejemplo, en el período de seis años después de 1931 —cuando el sapo de caña fue muy prolífico, y el escarabajo de mayo se vio en declinación dramática— se registró la precipitación más alta de la historia de Puerto Rico.[20] Sin embargo, la asunción de que el sapo de caña controló al escarabajo de mayo condujo a las introducciones de gran escala en muchas partes del Pacífico.
Fue exitosamente introducido en Nueva Guinea para el control de larvas de polillas halcón, las cuales se comían las cosechas de camotes. Desde su llegada han sido abundantes en regiones rurales y urbanas, tratando de no penetrar en áreas forestales; ya que la mayoría de su vida salvaje está restringida a áreas abiertas. No obstante, no ha causado problemas ambientales significantes.
En España, debido a su potencial colonizador y constituir una amenaza grave para las especies autóctonas, los hábitats o los ecosistemas, esta especie ha sido incluida en el Catálogo Español de Especies Exóticas Invasoras, regulado por el Real Decreto 630/2013, de 2 de agosto, estando prohibida su introducción en el medio natural, posesión, transporte, tráfico y comercio.[21]
Introducción en Australia
[editar]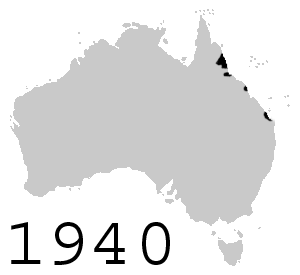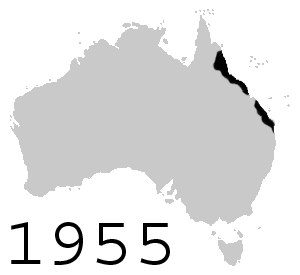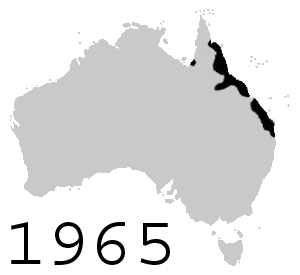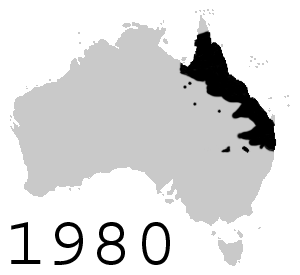
Con la intención de controlar al nativo escarabajo de caña, en junio de 1935, ciento dos sapos de caña fueron introducidos en Australia desde Hawái, los que inmediatamente se reprodujeron en cautiverio y por agosto de 1935 más de 3000 sapos jóvenes fueron liberados en áreas alrededor de Cairns, Gordonvale y Innisfail al norte de Queensland. Más sapos fueron liberados alrededor de Ingham, Ayr, Mackay y Bundaberg. Las liberaciones fueron temporalmente limitadas debido a preocupaciones ambientales, pero reasumidas en otras áreas después de septiembre de 1936. Desde entonces los sapos rápidamente aumentaron su población y ahora existen más de 200 millones.[22] Los sapos expandieron constantemente su rango por Queensland, alcanzando la frontera con Nueva Gales del Sur en 1978 y con Territorio del Norte en 1984. Se ha observado que, en su avance a la frontera occidental, han evolucionado para tener patas más largas;[23] esto se cree en referencia a su habilidad para viajar lejos. Se ha estimado que migran con un promedio de 40 km al año.[24]
El impacto a largo plazo en el ambiente australiano es difícil de determinar. Se han observado declives precipitados en poblaciones del cuol norteño después de que los sapos han invadido un área. Hay varios informes de declives en poblaciones de goannas y serpientes después de la llegada de los sapos.[25] La valoración del riesgo preliminar de sapos de caña en el Parque nacional Kakadu estimó que la depredación del sapo por la fauna nativa es el riesgo más grande a la biodiversidad. Otros factores, tales como la competencia con la fauna nativa por los recursos, y la depredación del sapo a la fauna nativa, eran considerados factores de riesgo mucho más bajos.[26] En el Territorio del Norte, la depredación del goanna a los sapos de caña se ha relacionado con una mayor cantidad de huevos indemnes del cocodrilo marino. El impacto completo de esto no se conoció hasta que los cocodrilos pusieron huevos en marzo del 2007.[27]
Un número de especies nativas han sido reportadas como depredadores exitosos de los sapos. Algunas aves, como el milano negro (Milvus migrans),[28] han aprendido a atacar al sapo en la barriga, evitando el veneno producido por las glándulas detrás de la cabeza. Reportes en el Territorio del Norte sugieren que la nativa rana del árbol de Dahl (Litoria dahlii), es capaz de comer renacuajos e individuos jóvenes sin ser afectadas por el veneno, que muchas veces mata a otros depredadores.[29] Se cree que esto hace más lento el avance de los sapos en ciertas áreas del Territorio del Norte. Se ha informado que algunas serpientes han evolucionado haciendo más pequeñas sus mandíbulas, lo que las hace incapaces de tragar sapos de caña grandes, que tienen mayores cantidades de veneno.[30]
A partir del 2005, la luz ultravioleta se ha usado para atraer, capturar y exterminar a los sapos de caña.[31] En junio del 2006, la Universidad de Queensland anunció una investigación en un gen para invertir el sexo de las hembras, lo que llevaría a aumentar la cantidad de machos, y así eliminar la población al no tener con quien reproducirse.[32] Sin embargo, se arriesgaría a una introducción inversa que expulsaría fuera a los sapos de caña, y posiblemente a otras especies de rango nativo.
En la cultura popular
[editar]
La introducción y migración del sapo de caña en Australia se popularizó por la película documental Cane Toads: An Unnatural History (1988), que relata la historia con un borde humorístico y se muestra a menudo en cursos de ciencia ambiental. Don Spencer, un popular actor de niños, canta la canción «Warts 'n' All», utilizada en el documental.
La novela para niños Rabía del sapo, de Morris Gleitzman, situada en Australia; trata de un sapo de caña llamado Limpy quien va en una aventura a descubrir por qué los humanos los detestan y quieren exterminarlos. La novela tiene dos secuelas, Cielo del sapo y Sapo fuera.
En la liga de rugby australiana, el Equipo de Origen del Estado de Queensland es informalmente conocido como los Sapos de Caña. Sus oponentes, el Equipo de Origen del Estado de Nueva Gales del Sur, son conocidos como las cucarachas.
La bufotenina, uno de los productos químicos excretado por el sapo de caña, es clasificada como una droga de Clase 1 bajo las leyes de drogas australianas. Está en la misma clasificación que la heroína y cocaína. Se cree que los efectos de la bufotenina son similares que los del envenenamiento suave; el efecto estimulante, el cual incluye leves alucinaciones, que duran menos de una hora.[33] Como el sapo de caña excreta bufotenina en muy pocas cantidades, y otras toxinas relativamente en más, una lamida del sapo podría causar serias enfermedades y muerte.[34]

En Australia, se han hecho tentativas de hacer uso de sapos de caña muertos, que pueden numerarse entre los miles y causar problemas de higiene. Esto incluye el tratamiento de los cadáveres en fertilizantes líquidos.[35] Su piel también puede utilizarse como cuero para ropa y accesorios.
En los estados australianos donde el sapo de caña es común, la crueldad hacia el sapo ha llegado a ser popular, hiriendo a los animales con palos de golf o bates de críquet. Sin embargo, estos ataques no son efectivos, ya que la fuerza ejercida por el palo de golf o el bate de críquet no son suficientes para matar a los animales de inmediato, incluso su veneno permanece tóxico después de morir. En abril de 2005, Dave Tollner, un miembro del parlamento del Territorio del Norte, llamó por la legalización de atacar al sapo de caña, el cual fue criticado por grupos de conservación de animales.[36] La corta película Cane Toad - What happened to Baz? demuestra la actitud australiana hacia el sapo de caña. Esta película ganó el premio a "Mejor Comedia" en el Festival de la Película de St. Kilda del 2003.[37] Aunque, el corto confiado en el humor con el cual los australianos se unen, y sus muestras en pantalla en festivales de ultramar han sido más reservados.
En la novela de Dave Barry Gran Problema, un sapo de caña tiene un pequeño papel aún importante.
El sapo de caña ha sido listado por el Fondo Nacional de Queensland como un icono del estado de Queensland, junto a la Gran Barrera de Coral, e iconos pasados, como el Royal Flying Doctor Service y el árbol de mango de patio trasero (también una especie introducida).[38]
Referencias
[editar]- ↑ Frank Solís, Roberto Ibáñez, Geoffrey Hammerson, Blair Hedges, Arvin Diesmos, Masafumi Matsui, Jean-Marc Hero, Stephen Richards, Luis Coloma, Santiago Ron, Enrique La Marca, Jerry Hardy, Robert Powell, Federico Bolaños, Gerardo Chaves, Paulino Ponce (2009). «Rhinella marina». Lista Roja de especies amenazadas de la UICN 2013 (en inglés). ISSN 2307-8235. Consultado el 9 de marzo de 2013.
- ↑ Frost, Darrel R. (2013). «Amphibian Species of the World: an Online Reference. Version 5.6» (en inglés). American Museum of Natural History, Nueva York, EEUU.
- ↑ a b c d «Enciclovida - Rhinella marina (consultado el 27 de febrero del 2020).».
- ↑ a b Wyse, E. (editor) (1997). Guinness Book of Records 1998. Guinness Publishing. p. 249. ISBN 0-85112-044-X.
- ↑ Lowe S., Browne M., Boudjelas S., De Poorter M. (2000). 100 de las Especies Exóticas Invasoras más dañinas del mundo. Una selección del Global Invasive Species Database. Publicado por el Grupo Especialista de Especies Invasoras (GEEI), un grupo especialista de la Comisión de Supervivencia de Especies (CSE) de la Unión Mundial para la Naturaleza (UICN), 12pp. Primera edición, en inglés, sacada junto con el número 12 de la revista Aliens, diciembre 2000. Versión traducida y actualizada: noviembre 2004.
- ↑ a b Lampo, M.; De Leo, G.A. (1998). «The Invasion Ecology of the Toad Bufo marinus: from South America to Australia». Ecological Applications. 8(2): 288-296.
- ↑ Estes, Richard and Richard Wassersurg (1963) A Miocene toad from Colombia, South America. Breviora, 193:1-13, December 5.
- ↑ Zug, George R., and Patricia B. Zug (1979). The Marine Toad, Bufo marinus: A Natural History Resume of Native Populations. Smithsonian Contributions to Zoology, Nº 284, 58 p.
- ↑ «The first fossil toad (Anura: Bufonidae) from the Cura-Mallín Formation (Río Pedregoso Member, middle Miocene) of Lonquimay, Araucania Region, Central Chile».
- ↑ «Scientific and Common Names of the Reptiles and Amphibians of North America». Consultado el 5 de junio de 2006.
- ↑ «Identifying a Cane Toad». Archivado desde el original el 7 de septiembre de 2006. Consultado el 7 de septiembre de 2006.
- ↑ Tyler, M. J. (1994). Australian Frogs A Natural History. Reed Books. pp. 108. ISBN 0-7301-0468-0.
- ↑ msn.com
- ↑ «Hallan en Australia un gigantesco ejemplar de sapo de caña, una especie muy tóxica para otros animales». Emol. 20 de enero de 2023. Consultado el 20 de enero de 2023.
- ↑ Anstis, M. (2002). Tadpoles of South-Eastern Australia: A Guide with Keys. Reed New Holland. p. 274. ISBN 1-876334-63-0.
- ↑ «issg Database: Ecology of Bufo marinus». Archivado desde el original el 17 de agosto de 2009. Consultado el 16 de mayo de 2006.
- ↑ Ely, C.A. (1944). «Development of Bufo marinus larvae in dilute sea water». Copeia. 56(4): 256.
- ↑ De León, L.F. & Castillo, A. 2015. RHINELLA MARINA (Cane Toad). SALINITY TOLERANCE. Herpetological Review 46(2):237-238.
- ↑ Angus, R. (1994). «Observation of a Papuan Frogmouth at Cape York [Queensland]». Aust. Birds. 28: 10-11.
- ↑ Freeland, W.J. (1985). «The Need to Control Cane Toads». Search. 16(7-8): 211-215.
- ↑ «Real Decreto 630/2013, de 2 de agosto, por el que se regula el Catálogo español de especies exóticas invasoras.». Boletín Oficial del Estado.
- ↑ «Institute for Molecular Bioscience, Killing off the cane toad». Archivado desde el original el 2 de octubre de 2006. Consultado el 6 de diciembre de 2006.
- ↑ «Toxic Toads Evolve Longer Legs, Study Says. 15/02/06. National Geographic News». Consultado el 19 de mayo de 2006.
- ↑ Tyler, M. J. (1994). Australian Frogs A Natural History. Reed Books. pp. 112. ISBN 0-7301-0468-0.
- ↑ Mayes, P.J.; Thompson, G. G. and Withers P.C. (2005). «Diet and foraging behaviour of the semi-aquatic Varanus mertensi (Reptilia: Varanidae)». Wildlife Research 32: 67-74.
- ↑ «SSR164 - A preliminary risk assessment of cane toads in Kakadu National Park». Consultado el 22 de mayo de 2006.
- ↑ «Cane toad impact will boost croc hatchling numbers, researchers say». Archivado desde el original el 11 de diciembre de 2007. Consultado el 15 de octubre de 2006.
- ↑ Mitchell, D.; Jones, A. Hero, J.-M. (1995). «Predation on the Cane Toad (Bufo marinus) by the black kite (Milvus migrans)». Memoirs - Wueensland Museun 38: 512-531.
- ↑ «NT frog 'eats' Cane Toad. 15/15/2004. ABC News Online». Archivado desde el original el 16 de diciembre de 2004. Consultado el 9 de mayo de 2006.
- ↑ Phillips, Ben L.; Shine, Richard (diciembre de 2004). «Adapting to an invasive species: Toxic Cane Toads induce morphological change in Australian snakes». PNAS. 101(49): 17150-17155.
- ↑ «Northern Australian Frog Database System». Consultado el 20 de mayo de 2006.
- ↑ «ABC news online: Gender bending could see cane toad's end». Archivado desde el original el 14 de junio de 2006. Consultado el 7 de junio de 2006.
- ↑ «Radar:Really caning it». Archivado desde el original el 12 de septiembre de 2006. Consultado el 30 de mayo de 2006.
- ↑ Weil, A.T.; Davis, W. (1994). «Bufo alvarius: a potent hallucinogen of animal origin.». Journal of Ethnopharmacology. 41(1-2): 1-8.
- ↑ «Toads as Fertilizer - DirtDoctor.com - Howard Garrett». Archivado desde el original el 19 de junio de 2006. Consultado el 7 de junio de 2006.
- ↑ «Cane toad clubbing sparks controversy». Archivado desde el original el 12 de abril de 2005. Consultado el 20 de junio de 2006.
- ↑ «cane-toad.com». Archivado desde el original el 3 de julio de 2006. Consultado el 2 de julio de 2006.
- ↑ «National Trust Queensland National Icons». Archivado desde el original el 19 de septiembre de 2006. Consultado el 17 de octubre de 2006.
- Tyler, M. J. (1994). Australian Frogs A Natural History. Reed Books. ISBN 0-7301-0468-0.
- Lever, C. (2001). The Cane Toad. The history and ecology of a successful colonist. Westbury Publishing. ISBN 1-84103-006-6.
- Barker, J.; Grigg, G.C.; Tyler,M.J. (1995). A Field Guide to Australian Frogs. Surrey Beatty & Sons. ISBN 0-949324-61-2.
- «Cane Toad». Archivado desde el original el 16 de mayo de 2006. Consultado el 8 de mayo de 2006.
- «Discover Life - Bufonidae: Bufo marinus (Linnaeus, 1758) - Cane toad, Giant toad, Marine toad, Sapo grande». Archivado desde el original el 2 de septiembre de 2007. Consultado el 18 de mayo de 2006.
- «ADW: Bufo marinus: Information». Consultado el 23 de mayo de 2006.
- Freeland, W.J. (1985). «The Need to Control Cane Toads». Search. 16(7-8): 211-215.
- Lawson, Walter J. (1987). The Cane Toad, Bufo marinus: A Bibliography (AES working paper). School of Australian Environmental Studies, Griffith University. ISBN 0-86857-247-0.
- «He who walks behind the rows - Bufonidae: Bufo marinus (Linnaeus, 1758) - Cane toad, Giant toad, Marine toad, Sapo grande».
Enlaces externos
[editar]- The Cane Toad - Australia's Amphibian Plague at h2g2 (en inglés)
- Cane Toad factsheet - Australian Museum (en inglés)