Praseodym(III,IV)-oxid
Praseodym(III,IV)-oxid (Pr6O11) ist eine chemische Verbindung der chemischen Elemente Praseodym und Sauerstoff aus der Gruppe der Metalloxide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
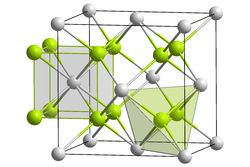
| _ Pr3+/4+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Praseodym(III,IV)-oxid | |||||||||||||||
| Verhältnisformel | Pr6O11 | |||||||||||||||
| Kurzbeschreibung |
schwarzer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 1021,44 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
6,5 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
4200 °C[1] | |||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Vorkommen
BearbeitenPraseodym(III,IV)-oxid kommt natürlich als Beimischung in Mineralien wie Bastnäsit, Monazit und Xenotim vor.[2]
Gewinnung und Darstellung
BearbeitenPraseodym(III,IV)-oxid kann durch Verbrennung von Praseodym mit Sauerstoff gewonnen werden.[3]
Eigenschaften
BearbeitenPraseodym(III,IV)-oxid ist ein schwarzer geruchloser Feststoff, der praktisch unlöslich in Wasser ist.[1] Das dreiwertige Praseodym ist zweifach, das vierwertige Praseodym ist viermal vertreten. Formal kann man es als Pr2O3 · 4 PrO2 auffassen. Es kristallisiert im kubischen Kristallsystem in der Fluorit-Struktur, wobei 1/12 der Sauerstoffplätze unbesetzt bleiben; der Gitterparameter beträgt 546,8 pm.[4][5][6] Es zersetzt sich bei Kontakt mit Wasserdampf zu Praseodym(IV)-oxid und Praseodym(III)-hydroxid.[7]
Zu beachten ist, dass noch andere Zwischenphasen zwischen Praseodym(III)-oxid und Praseodym(IV)-oxid existieren mit der allgemeinen Formel 2 Pr2O3 · m PrO2 (0 <= m <= 8) bzw. PrnO2n-2 (4 <= n <= 12).[8]
Verwendung
BearbeitenPraseodym(III,IV)-oxid wird für das Färben von Glas und Keramik verwendet.
Literatur
Bearbeiten- R. L. Martin: „Oxides of Praseodymium“, Nature (4. Februar 1950), 165, S. 202–203 (doi:10.1038/165202b0).
- T. Weisemoeller, C. Deiter, F. Bertram, S. Gevers, A. Giussani, P. Zaumseil, T. Schroeder, J. Wollschläger: „Epitaxy of single crystalline PrO2 films on Si(111)“, in: Appl. Phys. Lett., 2008, 93, 032905 (doi:10.1063/1.2958227; PDF).
- M. Shamshi Hassan, M. Shaheer Akhtar, Kyung-Bo Shim, O-Bong Yang: „Morphological and Electrochemical Properties of Crystalline Praseodymium Oxide Nanorods“, in: Nanoscale Research Letters, 2010, 5, S. 735–740 (doi:10.1007/s11671-010-9547-8).
- Sergio Ferro: „Physicochemical and Electrical Properties of Praseodymium Oxides“, International Journal of Electrochemistry, Volume 2011, Article ID 561204, 7 pages (doi:10.4061/2011/561204).
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i j Eintrag zu CAS-Nr. 12037-29-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Februar 2013. (JavaScript erforderlich)
- ↑ V. S. Sastri, Jean-Claude G. Bunzli, V. Ramachandra Rao: Modern Aspects of Rare Earths and Their Complexes. Elsevier Science & Technology, 2003, ISBN 978-0-444-51010-5, S. 13 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ginya Adachi, Nobuhito Imanaka, Zhen Chuan Kang: Binary rare earth oxides. Springer Netherlands, 2004, ISBN 978-1-4020-2568-6, S. 166 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Christian Klixbüll Jørgensen, Elfriede Riitershaus: "Powder-diagram and Spectroscopic Studies of Mixed Oxides of Lanthanides and Quadrivalent Metals", in: Mat. Fys. Medd. Dan. Vid. Selsk., 1967, 35 (15), S. 1–38, hier: S. 15 (PDF (Seite dauerhaft nicht mehr abrufbar, festgestellt im Mai 2019. Suche in Webarchiven)).
- ↑ J. D. McCullough: "An X-Ray Study of the Rare-earth Oxide Systems: CeIV—NdIII, CrIV—PrIII, CeIV—PrIV and PrIV—NdIII", in: J. Am. Chem. Soc., 1950, 72 (3), S. 1386–1390 (doi:10.1021/ja01159a085).
- ↑ E. Daniel Guth, J. R. Holden, N. C. Baenziger, LeRoy Eyring: "Praseodymium Oxides. II. X-Ray and Differential Thermal Analyses", in: J. Am. Chem. Soc., 1954, 76 (20), S. 5239–5242 (doi:10.1021/ja01649a088).
- ↑ Becky L. Treu, William Fahrenholtz, Matthew O’Keefe, Eric Morris, Richard Albers: "Effect of Phase on the Electrochemical and Morphological Properties of Praseodymium-Based Coatings", in: ECS Transactions, 2011, 33 (35), S. 53–66 (doi:10.1149/1.3577753; eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ R. A. Mashelkar: Solid State Chemistry: Selected Papers of C N R Rao. World Scientific, 1995, ISBN 981-279-589-8, S. 339 (eingeschränkte Vorschau in der Google-Buchsuche).
