EF-šaka
| EF-šaka | |
|---|---|
 | |
| Identifikatori | |
| Simbol | Efhand |
EF-šaka je heliks–petlja–heliksni strukturni domen ili motiv koji se nalazi u velikoj porodici kalcij-vezujućih proteina.
Motiv EF-šake sadrži topologiju heliks–petlja–heliks, slično kao rašireni palac i kažiprst ljudske šake, u kojoj su ioni Ca2+ koordinirani ligandima unutar petlje. motif je dobio ime po tradicijskoj nomenklaturi koja se koristi za opisivanje proteina parvalbumina, koji sadrži tri takva motiva i vjerovatno je uključen u opuštanje mišića putem svoje kalcij-ovisne aktivnosti.
EF-šaka sastoji se od dva alfa heliksa povezana kratkom regijom petlje (obično oko 12 aminokiselina) koja obično vezuje kalcijewve ione. EF-šake se također pojavljuju u svakom strukturnom domenu proteina za ćelijsku signalizaciju kalmodulina i u mišićnom proteinu troponin-C.
Mjesto vezanja iona kalcija
[uredi | uredi izvor]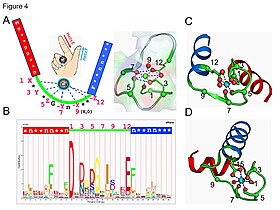
- Kalcijev ion koordiniran je u pentagonskoj bipiramidnoj konfiguraciji. Šest ostataka uključenih u vezivanje su na pozicijama 1, 3, 5, 7, 9 i 12; ovi ostaci su označeni sa X, Y, Z, –Y, –X i –Z. Invarijantni Glu ili Asp na poziciji 12 daju dva kisika za ligandiranje Ca (dvozubi ligand).
- Kalcijev ion vezan je i za atome proteinske kičme i za bočni lanac aminokiselina, posebno onih kiselih aminokiselinskih ostataka aspartata i glutamata. Ovi ostaci su negativno nabijeni i jmaju interakciju naboja s pozitivno nabijenim ionom kalcija. Motiv EF-šake bio je među prvim strukturalnim motivima čiji su zahtjevi sekvence detaljno analizirani. Pet ostataka petlje vezuju kalcij i stoga imaju jaku prednost za bočne lance koji sadrže kisik, posebno aspartat i glutamat. Šesti ostatak u petlji je nužno glicin, zbog konformacijskih zahtjeva kičme. Preostali ostaci su tipski hidrofobni i formiraju hidrofobno jezgro koje vezuje i stabilizuje dvije spirale.
- Nakon vezivanja za Ca2+, ovaj motiv može pretrpjeti konformacijske promjene koje omogućavaju Ca2+-regulirane funkcije kao što se vidi u efektorima Ca2+ kao što su kalmodulin (CaM) i troponin C (TnC) i Ca2+ puferi kao što su kalretikulin i kalbindin D9k. Dok većina poznatih proteina koji vezuju kalcij EF-šake (CaBP) sadrži uparene motive EF-šake, CaBP s EF-šakama također su otkriveni i kod bakterija i kod eukariota. Osim toga, u brojnim bakterijama pronađeni su "motivi nalik na EF-šake". Iako svojstva koordinacije ostaju slična s kanonskim motivom heliks–petlja–heliks EF-šake od 29 ostataka, motivi nalik EF-šakama razlikuju se od EF-šaka po tome što sadrže odstupanja u sekundarnoj strukturi bočnih sekvenci i/ili varijacija u dužini Ca2+-koordinacijske petlje.
- EF-šake imaju vrlo visoku selektivnost za kalcij. Naprimjer, konstanta disocijacije alfa parvalbumina za Ca2+ je ~1000 puta niža od one za sličan ion Mg2+.[2] Ova visoka selektivnost je zbog relativno krute geometrijske koordinacije, prisutnosti višestruko nabijenih bočnih lanaca aminokiselina na mjestu vezivanja, kao i svojstava rastvorljivosti iona.[3][4][5]
Predviđanje
[uredi | uredi izvor]
- Pretraga uzorka (potpisa motiva) jedan je od najjednostavnijih načina za predviđanje kontinuiranih EF-šakinih Ca2+-vezujućih mjesta u proteinima. Na osnovu rezultata poravnanja sekvenci kanonskih motiva EF-šaka, posebno konzerviranih bočnih lanaca direktno uključenih u Ca2+ vezivanje, uzorak prosite/nicedoc.pl?PS50222 PS50222 generisan je za predviđanje kanonskih EF-šaknih lokacija. Serveri za predviđanje mogu se naći u odjeljku vanjskih linkova.
Klasifikacija
[uredi | uredi izvor]- Od razgraničenja motiva EF-šake 1973. godine, porodica proteina EF-šaka se do sada proširila na najmanje 66 potporodica. Motivi EF-šaka podijeljeni su u dvije velike grupe::
- Kanonske EF-šake , kao što je kod kalmodulina (CaM) i prokariotski protein kaleritrin sličan CaM. Kanonska EF-ručna petlja sa 12 ostataka vezuje Ca2+ uglavnom preko karboksilata ili karbonila bočnog lanca (pozicije sekvence petlje 1, 3, 5, 12). Ostatak na osi –X koordinira Ca2+ jon kroz premošteni molekul vode. EF-ručna petlja ima bidentatni ligand (Glu ili Asp) na osi –Z.
- Pseudo EF-šake se nalaze isključivo u N-krajevima proteina sličnih S100 i S100. Pseudo EF-ručna petlja sa 14 ostataka helatira Ca2+ prvenstveno preko karbonila u kičmi (pozicije 1, 4, 6, 9).
Dodatne tačke:

- Proteini slični EF-u sa raznovrsnim bočnim strukturnim elementima oko Ca2+-vezujuće petlje su prijavljeni u bakterijama i virusima. Ovi prokariotski proteini nalik na EF-šakama su široko uključeni u signalizaciju Ca2+ i homeostazu u bakterija. Sadrže fleksibilne dužine Ca2+-vezujućih petlji koje se razlikuju od motiva EF-šaka. Međutim, njihova koordinacijska svojstva podsjećaju na klasične motive EF-šaka.
- Naprimjer, polukontinuirano mjesto vezivanja Ca2+ u proteinu koji vezuje D-galaktozu (GBP) sadrži petlju od devet ostataka. Ion Ca2+ koordinira sedam proteinskih atoma kisika, od kojih je pet iz petlje koja oponaša kanonsku EF-petlju, dok su druga dva iz karboksilatne grupe udaljenog Glu.
- Drugi primjer je novi domen pod nazivom Ekscalibur (venćelijski Ca2+-vezujući region) izoliran iz Bacillus subtilis. Ovaj domen ima konzerviranu Ca2+-vezujuću petlju sa 10 ostataka, zapanjujuće sličnu kanonskoj EF-šakioj petlji od 12 ostataka.
- Raznolikost strukture bočne regije ilustrovana je otkrićem domena sličnih EF-u u bakterijskim proteinima. Naprimjer, heliks–petlja–lanac umjesto strukture heliks–petlja–heliks nalazi se u periplazmatskom proteinu koji vezuje galaktozu (Salmonella typhimurium, PDB 1gcg) ili proteinu koji veže alginat (Sphingomonas sp., 1kwh); ulazni heliks nedostaje u zaštitnom antigenu (Bacillus anthracis, 1acc) ili dokerinu (Clostridium thermocellum, 1daq) .
- Među svim do sada prijavljenim strukturama, većina motiva EF-šaka je uparena ili između dva kanonska ili jednog pseudo i jednog kanonskog motiva. Za proteine sa neparnim brojem EF-šaka, kao što je penta-EF-šaka kalpain, motivi EF-šaka su povezani homo– ili heterodimerizacijom. Nedavno identificirana EF-šaka koja sadrži ER Ca2+ protein senzora, stromne interakcijske molekule 1 i 2 (STIM1, STIM2), pokazalo se da sadrži Ca2+-vezujući kanonski motiv EF-šake koji se uparuje s neposrednom, nizvodno atipskom "skrivenom" ne-Ca2+-vezujućom EF-šakom. Motivi pojedinačne EF-šake mogu poslužiti kao moduli za prerade proteina: naprimjer, jedna EF-šaka u NKD1 i NKD2 proteinima veže neuređene (DVL1, DVL2, DVL3) proteine.
- Funkcionalno, EF-šake se mogu podijeliti u dvije klase:
- 1) signalni proteini i
- 2) proteini za puferovanje/transport.
- Prva grupa je najveća i uključuje najpoznatije članove porodice kao što su kalmodulin, troponin C i S100B. Ovi proteini obično prolaze kroz konformacijsku promjenu ovisna o kalciju koja otvara ciljno mjesto vezivanja. Drugu grupu predstavlja kalbindin D9k i ne prolaze kroz konformacijske promjene zavisne od kalcija.
Potporodice
[uredi | uredi izvor]Primjeri
[uredi | uredi izvor]Ekvorin
[uredi | uredi izvor]Ekvorin je protein koji vezuje kalcijum (CaBP) izolovan iz Coelenterata Aequorea victoria. Ekvorin pripada porodici CaBP-ova EF-šaka, sa EF-šačnim petljama koje su blisko povezane sa CaBP-ima kod sisara. Osim toga, ekvorin se godinama koristi kao indikator Ca2+ i pokazalo se da je siguran i ćelije ga dobro podnose. Ekvorin se sastoji od dvije komponente – komponente koja vezuje kalcij apoekvorin (AQ) i hemiluminiscentne molekule koelenterazina. AQ dio ovog proteina sadrži EF-šačne domene za vezivanje kalcija.[6]
Ljudski proteini
[uredi | uredi izvor]Ljudski proteini koji sadrže ovaj domen uključuju:
- ACTN1; ACTN2; ACTN3; ACTN4; APBA2BP; AYTL1; AYTL2
- C14orf143; CABP1; CABP2; CABP3; CABP4; CABP5; CABP7; CALB1; CALB2; CALM2; CALM3; CALML3; CALML4; CALML5; CALML6; CALN1; CALU; CAPN1; CAPN11; CAPN2; CAPN3; CAPN9; CAPNS1; CAPNS2; CAPS; CAPS2; CAPSL; CBARA1; CETN1; CETN2; CETN3; CHP; CHP2; CIB1; CIB2; CIB3; CIB4; CRNN
- DGKA; DGKB; DGKG; DST; DUOX1; DUOX2
- EFCAB1; EFCAB2; EFCAB4A; EFCAB4B; EFCAB6; EFCBP1; EFCBP2; EFHA1; EFHA2; EFHB; EFHC1; EFHD1; EFHD2; EPS15; EPS15L1
- FKBP10; FKBP14; FKBP7; FKBP9; FKBP9L; FREQ; FSTL1; FSTL5
- GCA; GPD2; GUCA1A; GUCA1B; GUCA1C
- hippocalcin; HPCAL1; HPCAL4; HZGJ
- IFPS; ITSN1; ITSN2; KCNIP1; KCNIP2; KCNIP3; KCNIP4; KIAA1799
- LCP1
- MACF1; MRLC2; MRLC3; MST133; MYL1; MYL2; MYL5; MYL6B; MYL7; MYL9; MYLC2PL; MYLPF
- NCALD; NIN; NKD1; NKD2; NLP; NOX5; NUCB1; NUCB2
- OCM
- PDCD6; PEF1; PKD2; PLCD1; PLCD4; PLCH1; PLCH2; PLS1; PLS3; PP1187; PPEF1; PPEF2; PPP3R1; PPP3R2; PRKCSH; PVALB
- RAB11FIP3; RASEF; RASGRP; RASGRP1; RASGRP2; RASGRP3; RCN1; RCN2; RCN3; RCV1; RCVRN; REPS1; RHBDL3; RHOT1; RHOT2; RPTN; RYR2; RYR3
- S100A1; S100A11; S100A12; S100A6; S100A8; S100A9; S100B; S100G; S100Z; SCAMC-2; SCGN; SCN5A; SDF4; SLC25A12; SLC25A13; SLC25A23; SLC25A24; SLC25A25; SPATA21; SPTA1; SPTAN1; SRI
- TBC1D9; TBC1D9B; TCHH; TESC; TNNC1; TNNC2
- USP32
- VSNL1
- ZZEF1
Reference
[uredi | uredi izvor]- ^ Ban C, Ramakrishnan B, Ling KY, Kung C, Sundaralingam M (January 1994). "Structure of the recombinant Paramecium tetraurelia calmodulin at 1.68 A resolution". Acta Crystallogr. D. 50 (Pt 1): 50–63. doi:10.1107/S0907444993007991. PMID 15299476.
- ^ Schwaller, B. (13 October 2010). "Cytosolic Ca2+ Buffers". Cold Spring Harbor Perspectives in Biology. 2 (11): a004051. doi:10.1101/cshperspect.a004051. PMC 2964180. PMID 20943758.
- ^ Gifford, Jessica L.; Walsh, Michael P.; Vogel, Hans J. (15 July 2007). "Structures and metal-ion-binding properties of the Ca -binding helix–loop–helix EF-hand motifs". Biochemical Journal. 405 (2): 199–221. doi:10.1042/BJ20070255. PMID 17590154.
- ^ Dudev, Todor; Lim, Carmay (16 September 2013). "Competition among Metal Ions for Protein Binding Sites: Determinants of Metal Ion Selectivity in Proteins". Chemical Reviews. 114 (1): 538–556. doi:10.1021/cr4004665. PMID 24040963.
- ^ Jing, Zhifeng; Liu, Chengwen; Qi, Rui; Ren, Pengyu (23 July 2018). "Many-body effect determines the selectivity for Ca and Mg in proteins". Proceedings of the National Academy of Sciences. 115 (32): E7495–E7501. doi:10.1073/pnas.1805049115. PMC 6094099. PMID 30038003.
- ^ Detert JA, Adams EL, Lescher JD, Lyons JA, Moyer JR (2013). "Pretreatment with Apoaequorin Protects Hippocampal CA1 Neurons from Oxygen-Glucose Deprivation". PLOS ONE. 8 (11): e79002. doi:10.1371/journal.pone.0079002. PMC 3823939. PMID 24244400.
Dopunska literatura
[uredi | uredi izvor]- Branden C, Tooze J (1999). "Chapter 2: Motifs of protein structure". Introduction to Protein Structure. New York: Garland Pub. str. 24–25. ISBN 0-8153-2305-0.
- Nakayama S, Kretsinger RH (1994). "Evolution of the EF-hand family of proteins". Annu Rev Biophys Biomol Struct. 23: 473–507. doi:10.1146/annurev.bb.23.060194.002353. PMID 7919790.
- Zhou Y, Yang W, Kirberger M, Lee HW, Ayalasomayajula G, Yang JJ (November 2006). "Prediction of EF-hand calcium-binding proteins and analysis of bacterial EF-hand proteins". Proteins. 65 (3): 643–55. doi:10.1002/prot.21139. PMID 16981205. S2CID 8904181.
- Zhou Y, Frey TK, Yang JJ (July 2009). "Viral calciomics: interplays between Ca2+ and virus". Cell Calcium. 46 (1): 1–17. doi:10.1016/j.ceca.2009.05.005. PMC 3449087. PMID 19535138.
- Nakayama S, Moncrief ND, Kretsinger RH (May 1992). "Evolution of EF-hand calcium-modulated proteins. II. Domains of several subfamilies have diverse evolutionary histories". J. Mol. Evol. 34 (5): 416–48. doi:10.1007/BF00162998. PMID 1602495. S2CID 34614223.
- Hogue CW, MacManus JP, Banville D, Szabo AG (July 1992). "Comparison of terbium (III) luminescence enhancement in mutants of EF hand calcium binding proteins". J. Biol. Chem. 267 (19): 13340–7. doi:10.1016/S0021-9258(18)42216-8. PMID 1618836.
- Bairoch A, Cox JA (September 1990). "EF-hand motifs in inositol phospholipid-specific phospholipase C". FEBS Lett. 269 (2): 454–6. doi:10.1016/0014-5793(90)81214-9. PMID 2401372.
- Finn BE, Forsén S (January 1995). "The evolving model of calmodulin structure, function and activation". Structure. 3 (1): 7–11. doi:10.1016/S0969-2126(01)00130-7. PMID 7743133.
- Stathopulos PB, Zheng L, Li GY, Plevin MJ, Ikura M (October 2008). "Structural and mechanistic insights into STIM1-mediated initiation of store-operated calcium entry". Cell. 135 (1): 110–22. doi:10.1016/j.cell.2008.08.006. PMID 18854159.
- Nelson MR, Thulin E, Fagan PA, Forsén S, Chazin WJ (February 2002). "The EF-hand domain: a globally cooperative structural unit". Protein Sci. 11 (2): 198–205. doi:10.1110/ps.33302. PMC 2373453. PMID 11790829.
Vanjski linkovi
[uredi | uredi izvor]Eukaryotic Linear Motif resource motif class LIG_EH_1
Eukaryotic Linear Motif resource motif class LIG_IQ
Eukaryotic Linear Motif resource motif class DOC_PP2B_LxvP_1
Eukaryotic Linear Motif resource motif class LIG_IQ
- Nelson M, Chazin W. "EF-Hand Calcium-Binding Proteins Data Library". Vanderbilt University. Arhivirano s originala, 25. 8. 2009. Pristupljeno 2009-08-29.
- Haiech J. "EF-hand protein database (EF-handome)". European Calcium Society and the Université Libre de Bruxelles. Arhivirano s originala, 9. 8. 2009. Pristupljeno 2009-08-29.
upon request to [email protected]
- Yang J. "Calciomics". Georgia State University. Arhivirano s originala, 2009-10-12. Pristupljeno 2009-08-29.
prediction server for EF-hand calcium binding proteins