Titán-tetraklorid
| Titán-tetraklorid | |

| |

| |
| IUPAC-név | Titán-tetraklorid Titán(IV)-klorid |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 7550-45-0 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | TiCl4 |
| Moláris tömeg | 189.679 g/mol |
| Megjelenés | színtelen folyadék |
| Sűrűség | 1.726 g/cm³ |
| Olvadáspont | −24.1 °C |
| Forráspont | 136.4 °C |
| Oldhatóság (vízben) | nagyon jól oldódik, hidrolizál, amit füst jelez |
| Viszkozitás | 827 μPa s |
| Veszélyek | |
| EU osztályozás |  Korrozív Korrozív
|
| NFPA 704 | |
| R mondatok | R14, R34 |
| S mondatok | (S1/2), S7/8, S26, S30, S36/37/39, S45 |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A titán-tetraklorid TiCl4 képletű szervetlen vegyület, a titán fém gyártás és a titán-dioxid pigmentek gyártásának fontos köztes terméke. A titán-tetraklorid a megszokottól eltérő tulajdonságokkal rendelkező fém halogenid, mivel nagyon illó folyadék. A nedves levegővel érintkezésbe kerülő vegyület áttetsző TiO2-ot és HCl-ot képez.
Szerkezet és tulajdonságok
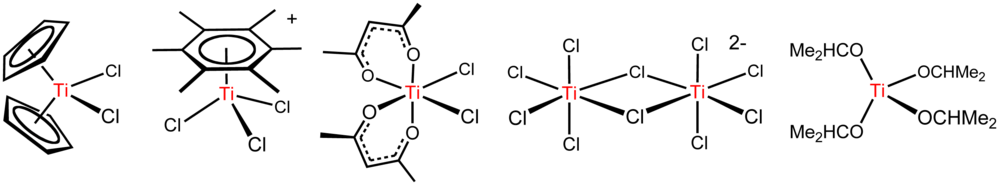
[szerkesztés]A TiCl4 sűrű, színtelen, desztillálható folyadék, bár a nyers termék akár sárga vagy vöröses-barna is lehet. Azon kevés átmenetifém-halogenidek egyike, amely szobahőmérsékleten folyékony halmazállapotú. Ebből következtetve a vegyületben minden molekula gyengén kötődik a szomszédos molekulákhoz, köztük van der Waals erők hatnak, amelyek magyarázzák a vegyület alacsony forrás és olvadáspontját.
A Ti4+ ion az argonhoz hasonló elektronszerkezettel rendelkezik, a titán-tetrakloridban pedig tetragonális szerkezet jön létre, középen a d0 fémmel, amit négy ligandum formájában vesznek körül a klóratomok. Ennek a konfigurációnak az eredménye egy nagyon szimmetrikus, tetragonális szerkezet, mely megegyezik a TiI4 és TiBr4 szerkezetével.
A TiCl4 oldódik toluolban és a szén klórral alkotott vegyületeiben is. Bebizonyították, hogy egyes arénekkel [(C6R6)TiCl3]+ formájú komplex vegyületeket hoz létre.
Előállítása
[szerkesztés]A titán-tetrakloridot klorid-eljárással állítják elő, mely lényegében abból állt, hogy a titán-oxid tartalmú érceket, általában ilmenitet (FeTiO3) szénnel redukálják folyamatos klórgáz áramlat mellett, 900 °C-on. A szennyeződéseket ezután desztillációval távolítják el.
- 2 FeTiO3 + 7 Cl2 + 6 C → 2 TiCl4 + 2 FeCl3 + 6 CO
A kívánt termék mellett még FeCl3 is keletkezik, ami a gyártási technológia továbbfejlesztéséhez vezetett. Az ilmenit helyett salakosított rutilt használnak, mely szennyezett TiO2, amit úgy nyernek, hogy az ilmenitből eltávolítják a vasat szenes redukcióval vagy kénsavval. A keletkező nyers titán-tetraklorid szennyeződésként VOCl3, SiCl4, SnCl4 vegyületeket is tartalmaz, amelyeket azonban el kell távolítani a rendszerből, ezt pedig általában desztillálással végzik.
Felhasználása
[szerkesztés]Titán fém gyártása
[szerkesztés]Világviszonylatban a titánt TiCl4-ból állítják elő. A folyamat a titán-tetraklorid magnéziummal való redukálásával valósul meg és magnézium-klorid keletkezik. Az eljárást még Kroll-eljárásnak is nevezik.
- 2 Mg + TiCl4 → 2 MgCl2 + Ti
Titán-dioxid előállítása
[szerkesztés]Az előállított titán-tetraklorid nagyjából 90%-át TiO2 pigmentek előállítására használják. A folyamat során a titán-tetrakloridot hidrolizálják, mely során sósav is keletkezik.
- TiCl4 + 2 H2O → TiO2 + 4 HCl
Egyes esetekben a titán-tetrakloridot oxigénnel direkt oxidálják
- TiCl4 + O2 → TiO2 + 2 Cl2
Kémiai reakciók
[szerkesztés]Hidrolízis
[szerkesztés]A legjelentősebb kémiai reakció, amelyben a titán-tetraklorid részt vesz a hidrolízis, mely a korrozív tulajdonságú sósav keletkezését eredményezi a titán-dioxid mellett. Régebben a titán-tetrakloridot füstfüggönyök előállítására is alkalmazták. Ugyanakkor keletkező hidrogén klorid azonnal leköti a megköti a környező vizet, így hidrogén-klorid cseppecskéket hozva létre, amelyek nagyon jól szétszórják a fénysugarakat, ezért világító testek létrehozására is használták, azonban a korrozív tulajdonságai miatt napjainkban már nem alkalmazzák ilyen célokra.
A titán-tetraklorid alkohollal is reagál, a reakció eredményeként alkoxidok keletkeznek, melyek több típusúak lehetnek, monomerek, dimerek, trimerek és tetramerek. Az ilyen anyagokat az anyagtechnológiában és a szerves szintézisekben egyaránt felhasználják.
Egyszerű ligandumos komplexek
[szerkesztés]A TiCl4 Lewis sav, mivel hidrolizál. Tetrahidrofuránnal (THF) reagálva sárga TiCl4(THF)2 kristályokat eredményez.
Redoxireakciók
[szerkesztés]A titán-tetrakloridot alumíniummal lehet redukálni, ennek eredményeként titán-triklorid (TiCl3) keletkezik, melynek eltérő tulajdonságai vannak a tetraklórozott vegyülethez képest. A titán-triklorid szilárd, paramágneses tulajdonságú koordinációs polimer.
Fém-organikus kémia
[szerkesztés]A titán fém-organikus kémiájának kiinduló anyaga a titán-tetraklorid, melyből aztán több titánt tartalmazó fém-organikus vegyületet állítanak elő, mint például a TiCl2(C5H5)2.
Toxicitás és biztonsági eljárások
[szerkesztés]A titán-tetraklorid toxicitása többnyire abból származik, hogy sósavat eredményez a hidrolizációs reakció során. Lewis-savként gyengébb bázisokkal is exoterm reakcióba lép, a vízzel pedig robbanásszerűen reagál korrozív sósavat eredményezve.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Titanium tetrachloride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.