Dionée attrape-mouche
Dionaea muscipula
| Règne | Plantae |
|---|---|
| Sous-règne | Tracheobionta |
| Division | Magnoliophyta |
| Classe | Magnoliopsida |
| Sous-classe | Dilleniidae |
| Ordre | Nepenthales |
| Famille | Droseraceae |
| Ordre | Caryophyllales |
|---|---|
| Famille | Droseraceae |
Répartition géographique
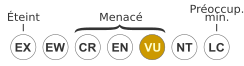
VU A1acd, B1+2c : Vulnérable
B1+2c
Statut CITES
La Dionée attrape-mouche (Dionaea muscipula) est une plante carnivore, sans doute la plus connue et la plus emblématique[1]. C'est une plante vivace herbacée de la famille des Droseraceae. C'est la seule espèce du genre Dionaea.
Découverte
modifierEn 1763, Arthur Dobbs, alors gouverneur de la Caroline du Nord, attira pour la première fois l'attention du public et des scientifiques européens sur la plante. Aux environs de 1770, Carl von Linné, botaniste suédois, étudia le végétal et le nomma « Vénus attrape-mouche » en s'inspirant de Vénus, déesse de l'amour et de la beauté dans la mythologie romaine. Néanmoins, on doit la description complète de la plante à John Ellis. Le mécanisme de capture de la « Vénus attrape-mouche » est stupéfiant, et poussa Charles Darwin à dire que la dionée était « la plante la plus merveilleuse au monde »[2]. Il a d'ailleurs décrit le régime alimentaire de la dionée[3].
Répartition géographique
modifierSon aire de répartition est limitée aux États-Unis, dans les seuls États de Caroline du Nord et de Caroline du Sud, sur environ 45 000 km². Elle pousse sur des sols pauvres en sels minéraux dans les marais acides, les tourbières à sphaignes (pH 3,5 à 4,9) [4].
Description
modifierLes feuilles de la Dionaea muscipula sont disposées en rosettes d'un diamètre variant de 10 à 15 centimètres à taille adulte (bien plus pour certaines variétés de culture) et sont composées d'un limbe en deux parties. L'inférieure a une largeur très variable par rapport à sa longueur, elle-même variable selon les variétés. La partie supérieure du limbe est formée par le piège, une sorte de mâchoire composée de deux lobes séparés et reliés par une nervure centrale épaisse. À la périphérie des deux lobes, on trouve une série de 15 à 20 dents marginales légèrement courbées vers l'intérieur. À la bordure des lobes et située sur la face interne des parois, la bande périphérique comporte des petites glandes sessiles qui sécrètent un nectar riche en glucides qui permet d'attirer les proies. La surface digestive (ou surface interne) sur laquelle se dressent trois poils disposés en triangle se trouve au centre des deux lobes et est couverte d'une multitude de glandes digestives.
Les fleurs de la Dionaea muscipula sont portées par une hampe florale d'une trentaine de centimètres, chaque hampe pouvant porter 2 à 15 fleurs disposées en ombelle. La fleur (3-4cm) se compose de 5 sépales, 5 pétales blancs, 5-15 étamines et d'un unique carpelle supère. Les fleurs de la Dionaea muscipula sont protandres : le pollen devient mature avant que le pistil ne soit réceptif. Ce caractère favorise la fécondation croisée avec un autre individu. Cependant, l'autopollinisation est possible.
Il est quelquefois possible d'observer un phénomène de « pseudo-viviparité » : une plantule se développe au niveau de la hampe florale, qui peut ensuite être séparée. Ce phénomène intéressant pourrait montrer que les fleurs sont en fait des feuilles modifiées. Il semblerait favorisé lors d'alternance entre nuits fraiches et journées chaudes[5].
-
Ombelle florale de Dionée.
-
Pseudo-viviparité sur une hampe de Dionée.
Nutrition
modifierLes plantes carnivores doivent avoir un apport nutritif supplémentaire par rapport aux autres plantes, car les substances essentielles à leur alimentation sont insuffisantes dans les sols. L’insuffisance peut résulter de la faible diversité des nutriments ou de leur trop faible densité[6]. La Dionée attrape-mouche, quant à elle, pousse dans un sol constitué de tourbe et de sable, puisqu’on la retrouve principalement dans les tourbières de la Caroline du Nord et celle du Sud[7]. Elle doit donc, comme toute autre plante carnivore, prendre ses ressources alimentaires d’une source autre que le sol : les insectes[6].
Les insectes possèdent deux types de composantes essentielles aux plantes carnivores : les macroéléments, nécessaires aux plantes en plus grande quantité (azote, potassium, phosphore, calcium et magnésium), et les microéléments ou oligoéléments, nécessaires en petites quantités limitées (fer). Cependant, les plantes n’assimilent jamais tous les éléments et ceux assimilés ne sont jamais digérés dans leur entièreté. Ces plantes ne retirent que les éléments riches et essentiels pour lesquels elles ont des enzymes ou des radicaux libres qui permettent leur digestion. D’ailleurs, la digestion des substances alimentaires varie d’un genre ou d’une espèce à l’autre. En ce qui concerne la Dionée attrape-mouche, ses enzymes protéolytiques (qui permettent la dégradation de protéines) sont l’amylase, la chitinase, l’estérase, la phosphatase, la protéase et la ribonucléase. Contrairement à d’autres plantes carnivores, elle n’a pas d’enzymes lipase ou peroxydase, donc ces éléments ne seront pas catalysés par la plante. Par contre, il est possible que d’autres organismes (bactéries, champignons ou commensaux) se trouvent dans son piège, et que ceux-ci produisent les enzymes non produites par la Dionée attrape-mouche. À ce moment-là, les lipides ou les composés peroxydes pourront être catalysés[6].
Toutes les enzymes de la Dionée attrape-mouche sont produites par les glandes digestives sessiles qui se trouvent à la surface supérieure du piège. Ces glandes sont aussi les endroits où la plante absorbera ses éléments nutritifs. Les enzymes protéolytiques produites seront excrétées hors des cellules des glandes et constitueront en partie le liquide digestif. De plus, le pH de celui-ci se trouvera entre 2,5 et 3,5. Ces deux derniers facteurs combinés renforceront l’activité enzymatique et permettront la catalyse des substances alimentaires. La Dionée attrape-mouche prendra en tout une vingtaine d’heures pour commencer sa digestion après la prise de sa proie. Les éléments digérés finiront par devenir des acides aminés qui pénétreront dans les tissus et circuleront dans les vaisseaux du xylème pour être acheminés ailleurs[6].
La Dionée attrape-mouche prendra deux à trois semaines pour digérer une proie, mais elle peut prendre plus de temps si l’insecte est de grande taille. Elle réabsorbera le liquide digestif avant d’ouvrir à nouveau son piège et il ne restera que l’exosquelette chitineux de l’insecte, car il ne peut pas être digéré[6].
Contre toute attente, des études montrent que les plantes carnivores utiliseraient les insectes non seulement comme ressource alimentaire, mais aussi comme ressource énergétique. Bien que, comme toutes plantes, les carnivores utilisent en général les rayons solaires comme apport énergétique et les éléments du sol comme apport alimentaire (photoautotrophie), elles peuvent tout de même utiliser les insectes consommés comme source nutritive et aussi comme source d’énergie lorsqu’elles se trouvent en absence totale de lumière. Donc, les plantes carnivores, comme la Dionée attrape-mouche, sont, jusqu’à un certain point, hétérotrophes[6].
Fonctionnement du piège
modifierLes insectes sont attirés par une odeur qui se dégage au niveau du piège, sans doute plus précisément au niveau des glandes nectarifères du pourtour. Le piège se referme grâce à des poils sensitifs qui se plient facilement dès qu'il y a deux contacts en un temps limité et déclenchent alors la fermeture. La fermeture (thigmonastie) et la suite des mécanismes sont complexes et mal connus car il n'y a pas de fibres contractiles analogues à celles des muscles animaux et chaque cellule une fois allongée ne pourra pas revenir au stade antérieur. La digestion qui s'ensuit est, par contre, plus classique, les enzymes protéolytiques existant aussi bien dans les cellules animales que végétales pour les mécanismes intra-cellulaires : il y a « simplement » libération à l'extérieur. Certains points sont détaillés ci-dessous mais il est clair que certaines étapes sont reprises de connaissances plus générales en physiologie végétale et n'ont pas forcément été démontrées ou étudiées spécifiquement chez la Dionaea.
Origine de la fermeture
modifierLes poils sensibles, quatre de chaque côté, sont responsables de la fermeture. De plus, deux stimulations du piège sont nécessaires pour que celui-ci se referme, ces dernières devant être effectuées dans un intervalle de temps de 20 secondes[8]. Ce déclenchement en deux temps évite au piège des fermetures inutiles, provoquées par exemple par le contact de poussières, de débris végétaux ou surtout de gouttes d'eau.
Dès 1873, des mesures de potentiel ont été effectuées[9] parce qu'un signal électrique pouvait a priori expliquer la rapidité de la fermeture du piège. La fermeture rapide du piège est corrélée avec le déclenchement d'au moins deux potentiels d'action (PA) : à chaque contact avec le poil sensitif, un potentiel d'action est libéré.
En 1991, Fagerberg imbibe les pièges par une solution d'ions lanthane (La3+)[10] et constate par la suite que les pièges sont anesthésiés et ne fonctionnent plus même après deux stimulations. Or, une solution d'ions lanthane est puissamment chélatée par les canaux à ions chlorure Cl-. Cela permet une interaction avec le canal ionique et ainsi de le bloquer à cause de la taille très importante de son atome. On peut donc déduire que le potentiel d'action qui est émis est en lien avec des canaux chlorure.
Dans le cas du piège de Dionaea, la totalité des cellules baigne dans le liquide interstitiel, contenant de nombreux ions de différentes natures. Or, le milieu intracellulaire et ce liquide sont tous deux riches en ions, mais avec des concentrations très différentes : le milieu extracellulaire est beaucoup plus concentré en cations et plus précisément en ions calcium Ca2+ que le milieu intracellulaire, lui beaucoup plus riche en anions, ici des ions chlorure Cl-.
Mécanisme de fermeture
modifierCette perturbation du potentiel de repos va provoquer ensuite une onde électrique qui se propage par la membrane plasmique dans toutes les cellules du piège. La modification du potentiel de repos d'une première cellule sensorielle provoque donc une modification dans les membranes des cellules voisines, créant un nouveau potentiel d'action et ainsi de suite, jusqu'à ce que cette onde électrique arrive aux cellules « motrices », responsables du mouvement du piège. Cette propagation s'effectue donc grâce à une « réaction en chaîne » où chaque cellule intervient, ce qui permet à l'onde électrique de ne pas perdre en intensité.
L'onde électrique, parvenue aux cellules de la face interne du piège, va permettre l'activation d'une nouvelle enzyme intervenant dans le processus de fermeture du piège, la pompe à protons. Une fois actionnée, la pompe, située au niveau de la membrane cellulaire, va libérer de l'acidité sous forme d'ions H+.
La pompe à protons va donc transférer des ions H+ et donc de l'acidité de l'intérieur de la cellule de la face interne du piège à la membrane des cellules de la face externe du piège. Il faut également noter que cette pompe, bien qu'elle soit active après une stimulation électrique, ne libère de l'acide qu'après deux stimulations. Ceci explique donc le fait qu'il faille deux stimulations au niveau des poils sensitifs pour que le piège se referme.
Les ions H+ libérés par la pompe à protons entraînent une acidification des cellules de la face externe du piège. L'acidité va ensuite agir sur les liaisons entre les fibres de la paroi, ce qui provoque une diminution des forces ioniques qui sont responsables de l'assemblage des fibres (polymères) qui constituent la paroi cellulaire solide autour des cellules. En conséquence, les parois externes vont se ramollir. Les cellules de la paroi vont ensuite profiter de ce ramollissement de leur « coque » pour s'étendre grâce à une entrée d'eau dans le milieu intracellulaire et plus précisément dans la vacuole. S'ensuit une resolidification des parois du lobe du piège due à l'allongement des cellules qui exercent plus de pression sur cette même paroi (pression osmotique), à l'image d'une feuille fanée retrouvant de l'eau. Le lobe du piège se courbe donc vers l'intérieur, les cellules de la face externe du lobe étant plus allongées que les cellules de la face interne.
Cultivars
modifierLes dionées attrape-mouche sont de loin les plantes carnivores les plus reconnues et cultivées. Elles sont vendues comme plantes d'intérieur et trouvées en jardineries ou encore en supermarché. L'expansion considérable du marché de ces plantes durant la dernière décennie a démultiplié la quantité de variétés via des cultures sélectives. Il s'agit ici de quelques cultivars, mais il en existe bien d'autres :
- Akai Ryu = Red Dragon[11]
- 'All Green'
- 'Tall Green'
- 'All Red' (variété ancienne « remplacée » par Royal Red ou Akai Ryu)
- 'Big Mouth'
- 'Bohemian Garnet'[12]
- B52' (cultivar géant, certains pièges atteignent jusqu'à 5 centimètres)
- 'Chunky'
- 'Crossed Teeth'
- 'Dente traps'
- 'Dent de Requin' (différente de 'Shark Teeth')
- 'Dutch'
- Diverses formes géantes (South West Giant, Low Giant, Big Mouth…)
- 'Dracula'
- 'Filiformis'
- 'Fine Tooth × Red'
- 'Fang'
- 'Fused Tooth'[13]
- 'Funnel Trap'
- 'Green Dragon'
- 'Jaws'
- 'Microdent'
- 'Paradisia'
- 'Pink Venus'
- 'Pompom' (faux cultivar, phénomène transitoire jusqu'à présent, les plants redeviennent normaux…)
- 'Red line'
- 'Red-Purple'
- 'Red Piranha
- 'Royal Red'
- 'Sawtooth' = 'Dentata' ('Dentata' est l'ancien nom, illégal à cause de la forme latine réservée aux plantes sauvages)
- 'Shark Teeth'
- 'Spider'
- 'Sawtooth' (pièges avec les dents en dents de scie)
- 'U.K Sawtooth'
- 'Pompom'
- 'White' (faux cultivar, ce n'est qu'un défaut au niveau de certains pièges, cette plante est sans doute issue de culture in vitro)
- 'Yellow'
Cycle de vie
modifierDans la nature, les dionées sont confrontées à des étés chauds (jusqu'à environ 35 °C) et des hivers plutôt rudes (jusqu'à -10 °C). Son cycle de vie est donc calqué sur les conditions environnementales.
Les arrosages doivent être fortement diminués en hiver (ils doivent juste maintenir le substrat humide) car la plante ralentit très fortement sa croissance et peut même l'arrêter si les conditions sont trop mauvaises. Si ce cycle n'est pas respecté, la plante risque de s'épuiser et peut en mourir après 3 ou 4 ans à ce rythme.
Ce « stress d'hiver » est important pour la plante car il permet également d'induire la floraison dès la reprise normale des soins.
La plante doit être rempotée au bout d'environ 3 ou 4 ans si elle a bien grandi et que le pot commence à être petit pour elle. Le rempotage se fait pendant l'hiver. On peut en profiter pour apporter un soin un peu spécial qui permettra à la plante de mieux s'acclimater à son nouveau pot et de repartir en faisant une grande floraison : au début de l'hiver, on peut couper toutes les feuilles et les racines de la plante pour ne garder que le rhizome et l'entreposer dans un endroit frais et humide de préférence enroulé dans un papier journal un peu humide. Ce traitement permet de simuler un hiver un peu rude pour la plante qui en ressortira revigorée lorsque vous replanterez le rhizome entre fin janvier et fin février.
Références
modifier- (en) Leoma Williams, « 10 carnivorous plants: discover incredible animal-killing plants with deadly traps », sur Discover Wildlife, (consulté le ).
- Insectivorous Plants. Darwin, C. (Murray, London, 1875).
- (en) Charles Darwin, Insectivorous Plants (lire en ligne), CHAPITRE XIII (DIONAEA MUSCIPULA)
- (en) Anonyme, « Venus Flytrap - Under Endangered Species Act review », United States Fish and Wildlife Service, Washington, D. C., , p. 1-2 (lire en ligne [PDF], consulté le ).
- D. E. Schnell, Les Plantes carnivores des États-Unis et du Canada.
- BARTHLOTT, Wilhelm, POREMBSKI, Stefan, SEINE, Rüdiger et THEISEN, Inge (2008). Plantes carnivores : Biologie et culture, Édition Belin, Paris, France, 248 p.
- BLONDEAU, Gérard (2011). Les plantes carnivores : Espèces et variétés, culture et reproduction, prévention et traitement des maladies, Éditions de Vecchi, Paris, France, 157 p.
- « Document sans titre », sur www.snv.jussieu.fr (consulté le )
- (en) John Scott Burdon-Sanderson, « Note on the electrical phenomena which accompany Irritation of the Leaf of Dionaea muscipula », Proceedings of the Royal Society of London, vol. 21, , p. 495-496
- Fagerberg WR, Allain D (1991) A quantitative study of tissue dynamics during closure in the traps of Venus's flytrap Dionaea muscipula Ellis. Am J Bot 78 647–657
- Carnivorous Plant Newsletter, volume 25, no 2, juin 1996, page 50.
- Carnivorous Plant Newsletter, volume 36, no 3, septembre 2007, pages 68 - 70.
- D'Amato, P. 1998. The Savage Garden, Ten Speed Press, Berkeley, California. 314 p.
Liens externes
modifierDionaea
modifier- (fr + en) Référence ITIS : Dionaea Ellis
- (en) Référence NCBI : Dionaea (taxons inclus)
- (en) Référence GRIN : genre Dionaea Sol. ex J. Ellis (+liste d'espèces contenant des synonymes)
- La dionée sur Infocarnivores.com
- La dionée : http://www.dionaea-muscipula.com
- Quelques informations sur les cultivars de la dionée et quelques conseils sur sa culture sur Dionaeadiversity.com
- Plante carnivore Dionée attrape-mouche vidéo. La vidéo montre le processus d'alimentation
Dionaea muscipula
modifier- (en) Référence Catalogue of Life : Dionaea muscipula Ellis (consulté le )
- (fr + en) Référence ITIS : Dionaea muscipula Ellis
- (en) Référence NCBI : Dionaea muscipula (taxons inclus)
- (en) Référence UICN : espèce Dionaea muscipula J.Ellis, 1768 (consulté le )
- (en) Référence GRIN : espèce Dionaea muscipula J. Ellis
- (en) Référence CITES : espèce Dionaea muscipula J.Ellis, 1768 (+ répartition sur Species+) (consulté le )
- (fr) Référence CITES : taxon Dionaea muscipula (sur le site du ministère français de l'Écologie) (consulté le )
- Dossier complet : culture, modes de reproduction, astuces, comparaisons des variétés, analyse des mutations…
- (en) Référence Fonds documentaire ARKive : Dionaea muscipula
- La dionée sur Biologie et Multimedia


