Protobionte
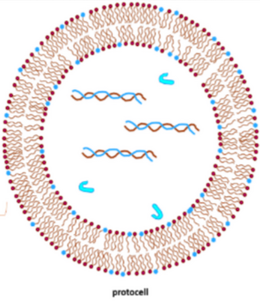
Un protobionte o protocélula es una colección esférica de lípidos, autoorganizada y ordenada endógenamente propuesta como predecesora de las células. Sin embargo también se suele usar para referirse a una etapa más avanzada del origen de la vida, en el cual es descrito como un tipo primitivo de organismo pre-celular, que teóricamente precedió a las células procariontes; en este último caso se utiliza igualmente el término progenote (pregenoma). Aunque aún no se ha logrado obtener un protobionte funcional en un entorno de laboratorio, el objetivo de comprender el proceso parece estar al alcance de la mano.[1][2]
Según relojes moleculares y evidencia fósil los protobiontes se originaron durante el Hádico entre unos 4500 y 4350 millones de años en las aguas de la Tierra primitiva. Estas estructuras pudieron formarse en cuestión de unos pocos millones de años y de hecho pudieron evolucionar a células muy rápidamente.[3][4][5]
Conceptos
[editar]Concepto de protobionte
[editar]
Un protobionte hace referencia a las primeras estructuras y formaciones de moléculas orgánicas que pudieron haber evolucionado en los primeros seres vivos. Dentro de los niveles de complejidad biológica, los protobiontes se consideran precursores de la vida celular.
El protobionte es un agregado acelular de polímeros orgánicos ensamblados espontáneamente de forma abiótica, rodeado por una estructura membranosa. Un ejemplo de protobionte está en los experimentos de Aleksandr Oparin y Sidney W. Fox, que han demostrado que pueden formarse espontáneamente en condiciones similares a las que se cree que existían en la época de la formación de la Tierra.[6] En estos experimentos se formaron liposomas y microesferas con estructuras membranosas similares a las bicapas fosfolipídicas de la célula.
A partir de ello, se ha discutido si el origen de la vida y el origen del proceso de evolución surgieron al mismo tiempo. Se ha postulado que, de forma equivalente a como actúa el proceso de evolución en los seres vivos, también actuarían los mecanismos evolutivos en compuestos químicos antes de que hubiese vida.
En este sentido, científicos como Martin A. Nowak y Hisashi Ohtsuki han postulado cómo y cuándo la cinética química pasa a convertirse en una dinámica evolutiva, formulando una teoría matemática general para el origen de la evolución. En ella se describe la previda como un alfabeto de activos monómeros que forman al azar polímeros, siendo un sistema generativo que puede producir la información, en la que originalmente se presenta una preevolutiva dinámica de selección y mutación, pero no replicación, a diferencia de la vida. A partir de análisis matemático se concluye que las mejores y más competentes candidatas moleculares para la vida ya habían sido seleccionadas antes incluso de que empezaran a reproducirse. Igualmente, aunque la previda es un andamiaje en que se basa la vida, existe una fase de transición en la que, si la tasa efectiva de replicación supera un valor crítico, entonces la vida compite con la previda y, finalmente, la vida destruye a la previda.[7]
Los protobiontes fueron estructuras lípidicas formadas por una sola membrana compuestas de ARN y proteínas, de tamaño nanómetrico, probablemente hayan tenido características vitales como reproducción asexual y capacidades metabólicas.[8][9] Fueron evolucionando a células al unirse más liposomas o vesículas cercanas sobre su única membrana lo cual llevó al desarrollo de una estructura más compleja que les permitiese proteger su material genético y proteínas, durante esta transición desarrollaron el ADN a partir del ARN como material genético. Al pasar esta etapa los protobiontes dieron origen al último antepasado común universal al desarrollar las características universales de las células como citoplasma, citoesqueleto, membrana plasmática y pared celular.[10] El último antepasado común universal (LUCA) fue un organismo procariota osmótrofo que posteriormente originaria al linaje bacteriano y al linaje arqueo-eucarionte.
Concepto de Progenote
[editar]Usualmente el término progenote se considera sinónimo de protobionte, pero en ocasiones se usa también para describir a una forma de vida celular primitiva equivalente del último antepasado común universal de todos los seres vivos y por ende antepasado de las células procariontes (las células más simples y primitivas conocidas); siendo por ello una estructura más evolucionada de protobionte que ya presentaría características celulares.[11] Es posible que la naturaleza filogenética del progenote haya intervenido toda una red de transferencia horizontal de genes.[12] Relacionado con este aspecto se ha estudiado cual sería el genoma mínimo necesario para la vida (genoma posiblemente equivalente al genoma del progenote); investigación que actualmente se ha llevado a cabo mediante la creación del Mycoplasma laboratorium.
Compartimentación
[editar]La compartimentación fue importante para el origen de la vida. Las membranas forman compartimientos cerrados que están separados del ambiente externo, proporcionando así al protobionte espacios acuosos funcionalmente especializados. Como la bicapa lipídica de las membranas es impermeable a la mayoría de las moléculas hidrófilas (disueltas en agua), las células tienen sistemas de transporte de membranas que logran la importación de moléculas nutritivas así como la exportación de desechos. Es muy difícil construir protobiontes a partir de ensamblajes moleculares. Un paso importante en este desafío es el logro de la dinámica de las vesículas que son relevantes para las funciones celulares, como el tráfico de membranas y la autorreproducción, utilizando moléculas anfifílicas. En la Tierra primitiva, numerosas reacciones químicas de compuestos orgánicos produjeron los ingredientes de la vida. De estas sustancias, las moléculas anfifílicas podrían ser el primer jugador en la evolución del ensamblaje molecular a la vida celular. Un paso de la vesícula a protobionte podría ser el desarrollo de vesículas autorreproductoras junto con el sistema metabólico.[13][14]
Otro enfoque de la noción de protobionte se refiere al término "quimiotón" (abreviatura de "autómata químico") que se refiere a un modelo abstracto para la unidad fundamental de la vida introducido por el biólogo teórico húngaro Tibor Gánti. Es el resumen computacional más antiguo conocido de un protobionte. Gánti concibió la idea básica en 1952 y formuló el concepto en 1971 en su libro "Los principios de la vida" (escrito originalmente en húngaro y traducido al inglés 2003). Supuso que el quimiotón era el ancestro original de todos los organismos o del último antepasado común universal (LUCA).[15]
La suposición básica del modelo quimiotón es que la vida debe tener fundamental y esencialmente tres propiedades: metabolismo, autorreplicación y una membrana lípidica. Las funciones metabólicas y de replicación juntas forman un subsistema autocatalítico necesario para las funciones básicas de la vida, y una membrana encierra este subsistema para separarlo del ambiente circundante. Por lo tanto, cualquier sistema que tenga tales propiedades puede considerarse vivo, estará sujeto a selección natural y contendrá una información celular autosostenida. Algunos consideran este modelo una contribución significativa al origen de la vida, ya que proporciona una filosofía de unidades evolutivas.[16][17]
Selectividad para la compartimentación
[editar]Los liposomas autoensamblados son componentes esenciales de los protobiontes. La segunda ley de la termodinámica requiere que el universo se mueva en una dirección en la que aumenta el desorden (o la entropía), pero la vida se distingue por su gran grado de organización. Por lo tanto, se necesita un límite para separar los procesos de la vida de la materia no viva. La membrana celular es la única estructura celular que se encuentra en todas las células de todos los organismos de la Tierra.[18][19]
Los investigadores Irene A. Chen y Jack W. Szostak (Premio Nobel de Fisiología o Medicina 2009), entre otros, demostraron que las propiedades fisicoquímicas simples de los protobiontes elementales pueden dar lugar a análogos conceptuales más simples de los comportamientos celulares esenciales, incluidas las formas primitivas de competencia y energía darwinianas de almacenamiento. Estas interacciones cooperativas entre la membrana y el contenido encapsulado podrían simplificar enormemente la transición de moléculas en replicación a células verdaderas. La competencia por las moléculas de membrana favorecería las membranas estabilizadas, lo que sugiere una ventaja selectiva para la evolución de los ácidos grasos reticulados e incluso los fosfolípidos actuales. Esta microencapsulación permitió el metabolismo dentro de la membrana, el intercambio de moléculas pequeñas y la prevención del paso de sustancias grandes a través de ella. Las principales ventajas de la encapsulación incluyen una mayor solubilidad de la carga y la creación de energía en forma de gradiente químico. Por lo tanto, a menudo se dice que las células almacenan energía en las estructuras de moléculas de sustancias como carbohidratos (incluidos los azúcares), lípidos y proteínas, que liberan energía cuando se combinan químicamente con oxígeno durante la respiración celular.[20][21]
Organización lípidica
[editar]
Cuando los fosfolípidos se colocan en agua, las moléculas se organizan espontáneamente de manera que las colas quedan protegidas o aisladas del agua, lo que da como resultado la formación de estructuras de membrana como bicapas, vesículas y micelas. En las células modernas, las vesículas participan en el metabolismo, el transporte, el control de la flotabilidad y el almacenamiento de enzimas. También pueden actuar como cámaras de reacción química natural. Una vesícula o micela típica en solución acuosa forma un agregado con las regiones de "cabeza" hidrófila en contacto con el solvente circundante, secuestrando el hidrófobo de cola única en el centro de la micela. Esta fase es causada por el comportamiento de empaquetamiento de los lípidos de una sola cola en una bicapa. Aunque el proceso de autoensamblaje protobionte que forma espontáneamente vesículas y micelas de monocapa lipídica en la naturaleza se asemeja a los tipos de vesículas o protobiontes primordiales que podrían haber existido al comienzo de la evolución, no son tan sofisticadas como las membranas bicapa de los organismos vivos de hoy.[22][23]
Sin embargo, en lugar de estar compuestas por fosfolípidos, las primeras membranas pueden haberse formado a partir de monocapas o bicapas de ácidos grasos, que pueden haberse formado más fácilmente en un entorno prebiótico. Los ácidos grasos se han sintetizado en laboratorios bajo una variedad de condiciones prebióticas y se han encontrado en meteoritos, lo que sugiere su síntesis natural en la naturaleza.[24]
Las vesículas de ácido oleico representan buenos modelos de protobiontes de membrana que podrían haber existido en tiempos prebióticos.[25]
Las interacciones electrostáticas inducidas por péptidos hidrófobos cortos, cargados positivamente, que contienen 7 aminoácidos de longitud o menos, pueden unir ácidos nucleicos a la membrana de una vesícula, la membrana celular básica.[26][27]
Estanques geotermales y arcillas
[editar]Los científicos han sugerido que la vida comenzó en respiraderos hidrotermales en las profundidades del mar. Un estudio de 2012 sugiere que las piscinas interiores de vapor geotérmico condensado y enfriado tienen las características ideales para el origen de la vida. La conclusión se basa principalmente en la química de las células modernas, donde el citoplasma es rico en iones de potasio, zinc, manganeso y fosfato, que no están muy extendidos en los ambientes marinos. Tales condiciones, argumentan los investigadores, se encuentran solo donde el fluido hidrotermal caliente trae los iones a la superficie, lugares como géiseres, ollas de barro, fumarolas y otras fuentes geotérmicas características. Dentro de estas cuencas humeantes y burbujeantes, el agua cargada de iones de zinc y manganeso podría haberse acumulado, enfriado y condensado en piscinas poco profundas.[28]
Otro estudio en la década de 1990 mostró que la arcilla de montmorillonita puede ayudar a crear cadenas de ARN de hasta 50 nucleótidos unidas espontáneamente en una sola molécula de ARN. Más tarde, en 2002, se descubrió que al agregar montmorillonita a una solución de micelas de ácidos grasos (esferas lipídicas), la arcilla aceleraba la tasa de formación de vesículas en 100 veces.[29]
Las investigaciones han demostrado que algunos minerales pueden catalizar la formación escalonada de colas de hidrocarburos de ácidos grasos a partir de gases de hidrógeno y monóxido de carbono, gases que pueden haber sido liberados por respiraderos hidrotermales o géiseres. Los ácidos grasos de diversas longitudes se liberan eventualmente en el agua circundante, pero la formación de vesículas requiere una mayor concentración de ácidos grasos, por lo que se sugiere que la formación de protobiontes comenzó en respiraderos hidrotermales terrestres como géiseres, ollas de barro, fumarolas y otras características geotérmicas donde el agua se evapora y concentra el soluto.[30][31]
Burbujas de montmorillonita
[editar]Otro grupo de investigadores sugiere que los protobiontes podrían haberse formado dentro de microcompartimientos de arcilla inorgánica, que pueden proporcionar un contenedor ideal para la síntesis y compartimentación de moléculas orgánicas complejas. Las burbujas con armadura de arcilla se forman naturalmente cuando las partículas de arcilla de montmorillonita se acumulan en la superficie exterior de las burbujas de aire bajo el agua. Esto crea una vesícula semipermeable a partir de materiales que están fácilmente disponibles en el medio ambiente. Los autores señalan que se sabe que la montmorillonita sirve como catalizador químico, lo que alienta a los lípidos a formar membranas y a los nucleótidos individuales a unirse en cadenas de ácidos nucleicos. Se puede imaginar una reproducción primitiva cuando las burbujas de arcilla estallan, liberando el producto ligado a la membrana lipídica al medio circundante.[32]
Gotas sin membrana
[editar]Otra forma de formar compartimentos primitivos que pueden conducir a la formación de un protobionte son las estructuras sin membrana de poliésteres que tienen la capacidad de albergar bioquímicos (proteínas y ácidos nucleicos) y anclar los conjuntos de lípidos a su alrededor.[33]
Transporte de membrana
[editar]Para los organismos celulares, el transporte de moléculas específicas a través de las barreras de la membrana compartimentadas es esencial para intercambiar contenido con su entorno y con otros individuos. Por ejemplo, el intercambio de contenido entre individuos permite la transferencia horizontal de genes, un factor importante en la evolución de la vida. Si bien las células modernas pueden depender de complicadas maquinarias de proteínas para catalizar estos procesos cruciales, los protobiontes deben haberlo logrado utilizando mecanismos más simples.[34]
Los protobiontes compuestos de ácidos grasos habrían podido intercambiar fácilmente pequeñas moléculas e iones con su entorno. Las membranas que constan de ácidos grasos tienen una permeabilidad relativamente alta a moléculas como el nucleósido monofosfato (NMP), nucleósido difosfato (NDP) y nucleósido trifosfato (NTP), y pueden resistir concentraciones milimolares de Mg2+. La presión osmótica también puede desempeñar un papel importante con respecto a este transporte pasivo de membrana.[35][36]
Se ha sugerido que los efectos ambientales desencadenan condiciones en las que es posible el transporte de moléculas más grandes, como ADN y ARN, a través de las membranas de los protobiontes. Por ejemplo, se ha propuesto que la electroporación resultante de los rayos podría permitir dicho transporte. La electroporación es el rápido aumento de la permeabilidad bicapa inducida por la aplicación de un gran campo eléctrico artificial a través de la membrana. Durante la electroporación, las moléculas de lípidos en la membrana cambian de posición, abriendo un poro (agujero) que actúa como una vía conductora a través de la cual moléculas hidrófobas como los ácidos nucleicos pueden pasar la bicapa lipídica. Una transferencia similar de contenido a través de las protoceldas y con la solución circundante puede ser causada por la congelación y posterior descongelación. Esto podría ocurrir, por ejemplo, en un entorno en el que los ciclos diurnos y nocturnos provocan heladas recurrentes. Los experimentos de laboratorio han demostrado que tales condiciones permiten un intercambio de información genética entre poblaciones de protobiontes. Esto puede explicarse por el hecho de que las membranas son altamente permeables a temperaturas ligeramente por debajo de su temperatura de transición de fase. Si se alcanza este punto durante el ciclo de congelación-descongelación, incluso las moléculas grandes y muy cargadas pueden atravesar temporalmente la membrana del protobionte.[37][38]
Algunas moléculas o partículas son demasiado grandes o demasiado hidrófilas para atravesar una bicapa lipídica incluso en estas condiciones, pero pueden moverse a través de la membrana mediante la fusión o gemación de vesículas, eventos que también se han observado en los ciclos de congelación-descongelación. Esto eventualmente puede haber conducido a mecanismos que faciliten el movimiento de moléculas hacia el interior del protobionte (endocitosis) o que liberen su contenido al espacio extracelular (exocitosis).[39][40]
Modelos artificiales
[editar]Biopelícula de Langmuir-Blodgett
[editar]Comenzando con una técnica comúnmente utilizada para depositar moléculas en una superficie sólida, la biopelícula de Langmuir-Blodgett, los científicos pueden ensamblar membranas de fosfolípidos de complejidad arbitraria capa por capa. Estas membranas de fosfolípidos artificiales apoyan la inserción funcional tanto de proteínas de membrana purificadas como expresadas in situ.[41]
Protobiontes de Jeewanu
[editar]Los protobiontes de Jeewanu son partículas químicas sintéticas que poseen una estructura similar a una célula y parecen tener algunas propiedades funcionales de la vida. Sintetizado por primera vez en 1963 a partir de minerales simples y orgánicos básicos mientras se expone a la luz solar, todavía se informa que tiene algunas capacidades metabólicas, la presencia de membrana semipermeable, aminoácidos, fosfolípidos, carbohidratos y moléculas de ácidos nucleicos. Sin embargo, la naturaleza y las propiedades de Jeewanu quedan por aclarar.[42]
En un experimento de síntesis similar, una mezcla congelada de agua, metanol, amoníaco y monóxido de carbono se expuso a la radiación ultravioleta (UV). Esta combinación produjo grandes cantidades de material orgánico que se autoorganizó para formar glóbulos o vesículas cuando se sumergió en agua. El investigador consideró que estos glóbulos se asemejan a las membranas celulares que encierran y concentran la química de la vida, separando su interior del mundo exterior. Los glóbulos tenían entre 10 y 40 micrómetros (0,00039 a 0,00157 pulgadas), o aproximadamente el tamaño de los glóbulos rojos. Sorprendentemente, los glóbulos fluorescentes, o brillaba, cuando se expone a la luz ultravioleta. Absorber los rayos UV y convertirlos en luz visible de esta manera se consideró una forma posible de proporcionar energía a un protobionte. Si tales glóbulos jugaron un papel en el origen de la vida, la fluorescencia podría haber sido un precursor de la fotosíntesis primitiva. Dicha fluorescencia también proporciona el beneficio de actuar como filtro solar, difundiendo cualquier daño que de otra manera sería infligido por la radiación UV. Esta función protectora habría sido vital para la vida en la Tierra primitiva, ya que la capa de ozono, que bloquea los rayos ultravioleta más destructivos del sol, no se formó hasta que la vida fotosintética comenzó a producir oxígeno.[43][44]
Se ha informado de la síntesis de tres tipos de "Jeewanu"; dos de ellos eran orgánicos y el otro era inorgánico. También se han producido otras estructuras inorgánicas similares. El científico investigador (VO Kalinenko) se refirió a ellos como "estructuras bio-similares" y "células artificiales". Formados en agua destilada (así como en gel de agar) bajo la influencia de un campo eléctrico, carecen de proteínas, aminoácidos, bases purínicas o pirimidínicas y ciertas actividades enzimáticas. Según los investigadores de la NASA, "los principios científicos actualmente conocidos de la biología y la bioquímica no pueden explicar las unidades inorgánicas vivientes" y "la existencia postulada de estas unidades vivientes no ha sido probada".[45]
El primer antepasado común universal (FUCA)
[editar]El primer antepasado común universal (FUCA) es una entidad acelular propuesta que fue el primer organismo con un código genético y capaz de traducir biológicamente moléculas de ARN en péptidos para producir proteínas. Sus descendientes incluyen al último antepasado común universal (LUCA) y los virus. FUCA estaba compuesto por una población de sistemas abiertos, ribonucleoproteínas autorreplicantes organizadas en protobiontes que habrían utilizado ARN como genoma y autorreplicación. FUCA se generó sin código genético, a partir de un protorribosoma y una ARN polimerasa dependiente de ARN típica de los virus de ARN en sí mismo un sistema evolucionado a partir de la maduración de una maquinaria de ribonucleoproteínas. FUCA apareció cuando un centro de protopeptidiil transferasa comenzó a surgir por primera vez, cuando los replicadores del mundo del ARN comenzaron a ser capaces de catalizar la unión de aminoácidos en oligopéptidos. Los primeros genes de FUCA probablemente codificaban ARNt primitivos ribosómicos, aminoaciltransferasas y otras proteínas que ayudaban a estabilizar y mantener la traducción biológica. Estos péptidos aleatorios producidos posiblemente se unieron a los polímeros de ácido nucleico de cadena simple y permitieron una mayor estabilización del sistema que se hizo más robusto y se unió aún más a otras moléculas estabilizadoras. Cuando FUCA maduró, su código genético quedó completamente establecido. Esto provocó que los sistemas abiertos precelulares comenzaran a acumular información y a autoorganizarse, produciendo los primeros genomas mediante el ensamblaje de vías bioquímicas. La era de FUCA habría ocurrido en el mundo de ARN + proteínas y el mundo de retrotranscripción antes de la aparición del último antepasado común universal (LUCA) y los virus complejos.[46][47][48]
Virus
[editar]Los protobiontes también se han asociado al origen de los virus. Según el consenso científico actual los virus se originaron antes que el último antepasado común universal (LUCA) en estas estructuras a partir de proteínas de microcompartimientos que forman estructuras proteicas similares a las cápsides y de ciertas moléculas de ARN o ADN que quedaron atrapadas dentro las cápsides. Se ha sugerido que varios virus que actualmente infectan procariotas como los virus de ARN o los de ADN bicatenario estuvieron presente en el viroma de los protobiontes y el último antepasado común universal. Un experimento (2015) ha demostrado que las cápsides de los virus pudieron haberse originado en el mundo de ARN y servían como un medio de transferencia horizontal entre las comunidades de replicadores de los protobiontes dado que estas comunidades no podrían sobrevivir si el número de parásitos génicos aumentaba, siendo ciertos genes los responsables de la formación de estas estructuras y los que favorecían la supervivencia de las comunidades autorreplicativas. El pensamiento evolucionista antiguo podía haber previsto a los virus como un eslabón intermediario entre las células y las moléculas simples tal como lo propusieron Felix d'Herelle en 1920 o J.B.S. Haldane en 1928. Sin embargo los estudios estructurales actuales han demostrado que las cápsides virales no son homólogas con las estructuras lípidicas de las células.[49][50][51]
Ética y controversia
[editar]La investigación sobre los protobiontes ha creado controversias y opiniones opuestas, incluidos los críticos de la vaga definición de "vida artificial". La creación de una unidad básica de vida es la preocupación ética más urgente, aunque la preocupación más generalizada sobre los protobiontes es su potencial amenaza para la salud humana y el medio ambiente a través de la reproducción incontrolada y su probable parasitismo sobre otros seres vivos complejos.[52]
Véase también
[editar]Referencias
[editar]- ↑ National Science Foundation (2013). «Exploring Life's Origins – Protocells». Consultado el 18 de marzo de 2014.
- ↑ Rasmussen, Steen (2 de julio de 2014). «Scientists Create Possible Precursor to Life». A Letters Journal Exploring the Frontiers of Physics 107 (2) (Astrobiology Web). Consultado el 24 de octubre de 2014.
- ↑ Courtland, Rachel (2 de julio de 2008). «Did newborn Earth harbour life?». New Scientist. Consultado el 27 de septiembre de 2014.
- ↑ Battistuzzi F, Feijao A, Hedges S. A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land. BMC.
- ↑ Fabia U. Battistuzzi & S. Blair Hedges 2008. A Major Clade of Prokaryotes with Ancient Adaptations to Life on Land. Mol Biol Evol (2009) 26 (2): 335-343. doi: 10.1093/molbev/msn247
- ↑ Cornell University: Protocells: What did the early protocells look like? Dump vom 5. Oktober 2012
- ↑ Martin A. Nowak y Hisashi Ohtsuki (2008). «Prevolutionary dynamics and the origin of evolution». Proceedings of the National Academy of Sciences 105 (39): 14924-14927. doi:10.1073/pnas.0806714105.
- ↑ Yarus M (2002). «Primordial genetics: phenotype of the ribocyte». Annual Review of Genetics 36: 125-51. PMID 12429689. doi:10.1146/annurev.genet.36.031902.105056.
- ↑ Gerald F. Joyce, Jack W. Szostak Protocells and RNA Self-Replication. Cold Spring Harbor Perpectives un Biology.
- ↑ Chen, Irene A.; Walde, Peter (July 2010). «From Self-Assembled Vesicles to Protocells». Cold Spring Harb Perspect Biol 2 (7): a002170. PMC 2890201. PMID 20519344. doi:10.1101/cshperspect.a002170.
- ↑ C. R. Woese and G. E. Fox (1977) J. Mol. Evol. 10, 1-6
- ↑ E. Hilario and J. P. Gogarten (1993) BioSystems 31, 111-119
- ↑ Deamer, D.W.; Dworkin, J.P. (2005). «Chemistry and Physics of Primitive Membranes». Top. Curr. Chem. Topics in Current Chemistry 259: 1-27. ISBN 3-540-27759-5. doi:10.1007/b136806.
- ↑ Walde, P (2006). «Surfactant Assemblies and their various possible roles for the origin(s) of life». Orig. Life Evol. Biosph. 36 (2): 109-50. Bibcode:2006OLEB...36..109W. PMID 16642266. doi:10.1007/s11084-005-9004-3.
- ↑ Marshall, Michael (14 de diciembre de 2020). «He may have found the key to the origins of life. So why have so few heard of him? - Hungarian biologist Tibor Gánti is an obscure figure. Now, more than a decade after his death, his ideas about how life began are finally coming to fruition.». National Geographic Society. Consultado el 15 de diciembre de 2020.
- ↑ Van Segbroeck S, Nowé A, Lenaerts T (2009). «Stochastic simulation of the chemoton». Artif Life 15 (2): 213-226. PMID 19199383. doi:10.1162/artl.2009.15.2.15203.
- ↑ Hoenigsberg HF (2007). «From geochemistry and biochemistry to prebiotic evolution...we necessarily enter into Gánti's fluid automata». Genet Mol Res 6 (2): 358-373. PMID 17624859.
- ↑ Vodopich, Darrell S.; Moore., Randy (2002). «The Importance of Membranes». Biology Laboratory Manual, 6/a. McGraw-Hill. Consultado el 17 de marzo de 2014.
- ↑ Shapiro, Robert (12 de febrero de 2007). «A Simpler Origin for Life». Scientific American 296 (6): 46-53. Bibcode:2007SciAm.296f..46S. PMID 17663224. doi:10.1038/scientificamerican0607-46.
- ↑ Chen, Irene A. (8 de diciembre de 2006). «The Emergence of Cells During the Origin of Life». Science 314 (5805): 1558-59. PMID 17158315. doi:10.1126/science.1137541.
- ↑ Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Biology: Exploring Life. Boston, MA: Pearson Prentice Hall. ISBN 978-0-13-250882-7.
- ↑ Walsby, AE (1994). «Gas vesicles». Microbiological Reviews 58 (1): 94-144. PMC 372955. PMID 8177173. doi:10.1128/MMBR.58.1.94-144.1994.
- ↑ Szostak, Jack W. (3 de septiembre de 2004). «Battle of the Bubbles May Have Sparked Evolution». Howard Hughes Medical Institute. Archivado desde el original el 27 de julio de 2023. Consultado el 20 de enero de 2021.
- ↑ National Science Foundation (2013). «Membrane Lipids of Past and Present». Exploring Life's Origins Project – A timeline of Life's Evolution. Consultado el 17 de marzo de 2014.
- ↑ Douliez, Jean-Paul; Zhendre, Vanessa; Grélard, Axelle; Dufourc, Erick J. (24 de noviembre de 2014). «Aminosilane/Oleic Acid Vesicles as Model Membranes of Protocells». Langmuir 30 (49): 14717-24. PMID 25420203. doi:10.1021/la503908z.
- ↑ «Peptide glue may have held first protocell components together».
- ↑ Kamat, Neha P.; Tobé, Sylvia; Hill, Ian T.; Szostak, Jack W. (2015). «Electrostatic Localization of RNA to Protocell Membranes by Cationic Hydrophobic Peptides». Angewandte Chemie International Edition 54 (40): 11735-39. PMC 4600236. PMID 26223820. doi:10.1002/anie.201505742.
- ↑ Switek, Brian (13 de febrero de 2012). «Debate bubbles over the origin of life». Nature –!News.
- ↑ Zimmer, Carl (26 de junio de 2004). «What Came Before DNA?». Discover Magazine: 1-5.
- ↑ Szostak, Jack W. (4 de junio de 2008). «Researchers Build Model Protocell Capable of Copying DNA». HHMI News (Howard Hughes Medical Institute).
- ↑ Cohen, Philip (23 de octubre de 2003). «Clay's matchmaking could have sparked life». New Scientist. «Journal reference: Science (vol 302, p 618 )».
- ↑ Stone, Howard A. (7 de febrero de 2011). «Clay-armored bubbles may have formed first protocells». Harvard School of Engineering and Applied Sciences.
- ↑ Jia, Tony Z.; Chandru, Kuhan; Hongo, Yayoi; Afrin, Rehana; Usui, Tomohiro; Myojo, Kunihiro; Cleaves, H. James (22 de julio de 2019). «Membraneless polyester microdroplets as primordial compartments at the origins of life». Proceedings of the National Academy of Sciences 116 (32): 15830-35. PMC 6690027. PMID 31332006. doi:10.1073/pnas.1902336116.
- ↑ Gyles, C.; Boerlin, P. (6 de diciembre de 2013). «Horizontally Transferred Genetic Elements and Their Role in Pathogenesis of Bacterial Disease». Veterinary Pathology (en inglés) 51 (2): 328-40. ISSN 0300-9858. PMID 24318976. doi:10.1177/0300985813511131.
- ↑ Müller, A. W. (June 2006). «Re-creating an RNA world». Cell Mol Life Sci 63 (11): 1278-93. PMID 16649141. doi:10.1007/s00018-006-6047-1.
- ↑ Ma, Wentao; Yu, Chunwu; Zhang, Wentao; Hu., Jiming (Nov 2007). «Nucleotide synthetase ribozymes may have emerged first in the RNA world». RNA 13 (11): 2012-19. PMC 2040096. PMID 17878321. doi:10.1261/rna.658507.
- ↑ Litschel, Thomas; Ganzinger, Kristina A.; Movinkel, Torgeir; Heymann, Michael; Robinson, Tom; Hannes Mutschler; Schwille, Petra (2018). «Freeze-thaw cycles induce content exchange between cell-sized lipid vesicles». New Journal of Physics (en inglés) 20 (5): 055008. Bibcode:2018NJPh...20e5008L. ISSN 1367-2630. doi:10.1088/1367-2630/aabb96.
- ↑ Demanèche, S; Bertolla, F; Buret, F (August 2001). «Laboratory-scale evidence for lightning-mediated gene transfer in soil». Appl. Environ. Microbiol. 67 (8): 3440-44. PMC 93040. PMID 11472916. doi:10.1128/AEM.67.8.3440-3444.2001.
- ↑ Norris, V.; Raine, D.J. (October 1998). «A fission-fussion origin for life». Orig Life Evol Biosph 28 (4): 523-37. PMID 9742727. doi:10.1023/A:1006568226145.
- ↑ Tsuji, Gakushi; Fujii, Satoshi; Sunami, Takeshi; Yomo, Tetsuya (19 de enero de 2016). «Sustainable proliferation of liposomes compatible with inner RNA replication». Proceedings of the National Academy of Sciences (en inglés) 113 (3): 590-95. Bibcode:2016PNAS..113..590T. ISSN 0027-8424. PMC 4725462. PMID 26711996. doi:10.1073/pnas.1516893113.
- ↑ Matosevic, Sandro; Paegel, Brian M. (29 de septiembre de 2013). «Layer-by-layer cell membrane assembly». Nature Chemistry 5 (11): 958-63. Bibcode:2013NatCh...5..958M. PMC 4003896. PMID 24153375. doi:10.1038/nchem.1765.
- ↑ Grote, M (September 2011). «Jeewanu, or the 'particles of life'». Journal of Biosciences 36 (4): 563-70. PMID 21857103. doi:10.1007/s12038-011-9087-0. Archivado desde el original el 23 de marzo de 2014.
- ↑ Gupta, V. K.; Rai, R. K. (2013). «Histochemical localisation of RNA-like material in photochemically formed self-sustaining, abiogenic supramolecular assemblies 'Jeewanu'». Int. Res. J. Of Science & Engineering 1 (1): 1-4. ISSN 2322-0015.
- ↑ Dworkin, Jason P.; Deamer, David W.; Sandford, Scott A.; Allamandola, Louis J. (30 de enero de 2001). «Self-assembling amphiphilic molecules: Synthesis in simulated interstellar/precometary ices». Proceedings of the National Academy of Sciences of the United States of America 98 (3): 815-19. Bibcode:2001PNAS...98..815D. PMC 14665. PMID 11158552. doi:10.1073/pnas.98.3.815.
- ↑ Caren, Linda D.; Ponnamperuma, Cyril (1967). «A review of some experiments on the synthesis of 'Jeewanu'». NASA Technical Memorandum X-1439.
- ↑ Prosdocimi, Francisco; José, Marco V.; de Farias, Sávio Torres (2019), «The First Universal Common Ancestor (FUCA) as the Earliest Ancestor of LUCA's (Last UCA) Lineage», en Pontarotti, Pierre, ed., Evolution, Origin of Life, Concepts and Methods (en inglés) (Cham: Springer International Publishing): 43-54, ISBN 978-3-030-30363-1, S2CID 199534387, doi:10.1007/978-3-030-30363-1_3, archivado desde el original el 29 de junio de 2022, consultado el 2 de noviembre de 2023.
- ↑ de Farias, Sávio Torres; Jose, Marco V.; Prosdocimi, Francisco (2021). «Is it possible that cells have had more than one origin?». Bio Systems 202: 104371. ISSN 1872-8324. PMID 33524470. doi:10.1016/j.biosystems.2021.104371. Archivado desde el original el 30 de diciembre de 2023. Consultado el 23 de febrero de 2024.
- ↑ Robertson MP, Joyce GF (May 2012). «The origins of the RNA world». Cold Spring Harbor Perspectives in Biology 4 (5): a003608. PMC 3331698. PMID 20739415. doi:10.1101/cshperspect.a003608.
- ↑ Krupovic, M; Dolja, VV; Koonin, EV (14 de julio de 2020). «The LUCA and its complex virome.». Nat Rev Microbiol. PMID 32665595. doi:10.1038/s41579-020-0408-x. Consultado el 16 de agosto de 2020.
- ↑ Eugene V Koonin, Tatiana G Senkevich, Valerian V Dolja (2006). The ancient Virus World and evolution of cells. Biology Direct.
- ↑ Matti Jalasvuori, Sari Mattila, Ville Hoikkala (2015). Chasing the Origin of Viruses: Capsid-Forming Genes as a Life-Saving Preadaptation within a Community of Early Replicators. Plos One. https://doi.org/10.1371/journal.pone.0126094
- ↑ Bedau, Mark A.; Parke, Emily C. (2009). The ethics of protocells moral and social implications of creating life in the laboratory (Online edición). Cambridge, MA: MIT Press. ISBN 978-0-262-51269-5.